Haryana State Board HBSE 10th Class Science Solutions Chapter 5 तत्वों का आवर्त वर्गीकरण Textbook Exercise Questions, and Answers.
Haryana Board 10th Class Science Solutions Chapter 5 तत्वों का आवर्त वर्गीकरण
HBSE 10th Class Science तत्वों का आवर्त वर्गीकरण Textbook Questions and Answers
प्रश्न 1.
आवर्त सारणी में बाईं से दाईं ओर जाने पर, प्रवृत्तियों के बारे में निम्न में से कौन-सा कथन असत्य है?
(a) तत्वों की धात्विक प्रकृति घटती है।
(b) संयोजकता इलेक्ट्रॉनों की संख्या बढ़ जाती है।
(c) परमाणु आसानी से इलेक्ट्रॉन का त्याग करते हैं।
(d) इसमें ऑक्साइड अधिक अम्लीय हो जाते हैं।
उत्तर-
(c) परमाणु आसानी से इलेक्ट्रॉन का त्याग करते हैं।
प्रश्न 2.
तत्व X, XCl2, सूत्र वाला एक क्लोराइड बनाता है जो एक ठोस है तथा जिसका गलनांक अधिक है। आवर्त सारणी में यह तत्व सम्भवतः किस समूह के अन्तर्गत होगा?
(a) Na
(b) Mg
(c) Al
(d) Si
उत्तर-
(b) Mg.
प्रश्न 3.
किस तत्व में
(a) दो कोश हैं तथा दोनों इलेक्ट्रॉनों से पूर्ण हैं?
(b) इलेक्ट्रॉनिक विन्यास 2, 8, 2 है?
(c) कुल तीन कोश हैं तथा संयोजकता कोश में चार इलेक्ट्रॉन हैं?
(d) कुल दो कोश हैं तथा संयोजकता कोश में तीन इलेक्ट्रॉन हैं?
(e) दूसरे कोश में पहले कोश से दोगुने इलेक्ट्रॉन हैं?
उत्तर-
(a) नीऑन (Ne)।
(b) मैग्नीशियम (Mg)।
(c) सिलिकॉन (Si)।
(d) बोरॉन (B)।
(e) कार्बन (C)।
![]()
प्रश्न 4.
(a) आवर्त सारणी में बोरॉन के स्तम्भ के सभी तत्वों के कौन-से गुणधर्म समान हैं?
(b) आवर्त सारणी में फ्लुओरीन के स्तम्भ के सभी तत्वों के कौन-से गुणधर्म समान हैं? ।
उत्तर-
(a) बोरॉन की भाँति, आवर्त सारणी के समान स्तम्भ में सभी तत्वों के बाह्यतम कोशों में तीन इलेक्ट्रॉन होते हैं अर्थात् इनकी संयोजकता तीन होती है। सभी विद्युत के सुचालक होते हैं।
(b) फ्लुओरीन की भाँति, आवर्त सारणी के समान स्तम्भ में सभी तत्वों के बाह्यतम कोशों में सात इलेक्ट्रॉन होते हैं तथा ये हैलोजेन कहलाते हैं। इन सभी की संयोजकता 1 होती है। सभी विद्युत के अचालक और भंगुर होते हैं।
प्रश्न 5.
एक परमाणु का इलेक्ट्रॉनिक विन्यास 2,8,7
(a) इस तत्व की परमाणु संख्या क्या है?
(b) निम्न में किस तत्व के साथ इसकी रासायनिक समानता होगी? (परमाणु संख्या कोष्ठक में दी गई है।)
N(7) F(9) P(15) Ar (18)
उत्तर-
(a) तत्व की परमाणु संख्या 17 है।
(b) यह रासायनिक रूप से F (9) के समान होगा।
प्रश्न 6.
आवर्त सारणी में तीन तत्व A, B, तथा C की स्थिति निम्न प्रकार है –
| वर्ग 16 | वर्ग 17 |
| – | – |
| – | A |
| – | – |
| B | C |
अब बताइए कि –
(a) A धातु है या अधातु।
(b) A की अपेक्षा C अधिक अभिक्रियाशील है या कम।
(c) C का साइज B से बड़ा होगा या छोटा।
(d) तत्व A किस प्रकार के आयन, धनायन या ऋणायन बनाएगा?
उत्तर-
(a) A अधातु है।
(b) A की तुलना में C कम अभिक्रियाशील है।
(c) B की तुलना में C छोटा होगा।
(d) तत्व A ऋणायन बनाएगा।
प्रश्न 7.
नाइट्रोजन (परमाणु-संख्या 7) तथा फॉस्फोरस (परमाणु-संख्या 15) आवर्त सारणी के समूह 15 के तत्व हैं। इन दोनों तत्वों का इलेक्ट्रॉनिक विन्यास लिखिए। इनमें से कौन-सा तत्व अधिक ऋणविद्युती होगा और क्यों?
उत्तर-
नाइट्रोजन (7) का इलेक्ट्रॉनिक विन्यास : 2, 5 फॉस्फोरस (15) का इलेक्ट्रॉनिक विन्यास : 2, 8, 5-नाइट्रोजन अधिक विद्युत्-ऋणात्मक होगा क्योंकि किसी समूह में ऊपर से नीचे जाने पर विद्युत ऋणात्मकता घटती है।
प्रश्न 8.
तत्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी में तत्व की स्थिति से क्या सम्बन्ध है?
उत्तर-
किसी तत्व का इलेक्ट्रॉनिक विन्यास आधुनिक आवर्त सारणी में इसकी स्थिति से सम्बन्धित होता है, जिन परमाणुओं के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या समान होती है, उन्हें समान समूह में रखा जाता है! किसी आवर्त में बाएँ से दाएँ चलते समय संयोजकता कोश में इलेक्ट्रॉनों की संख्या 1 इकाई बढ़ जाती है क्योंकि परमाणु क्रमांक 1 इकाई बढ़ जाता है।
प्रश्न 9.
आधुनिक आवर्त सारणी में कैल्सियम (परमाणु-संख्या 20) के चारों ओर 12, 19, 21 तथा 38 परमाणु-संख्या वाले तत्व स्थित हैं। इनमें से किन तत्वों के भौतिक एवं रासायनिक गुणधर्म कैल्सियम के समान हैं?
उत्तर-
इन तत्वों के इलेक्ट्रॉनिक विन्यास इस प्रकार हैं –
| परमाणु संख्या | इलेक्ट्रॉनिक विन्यास |
| 12 | 2,8,2 |
| 19 | 2,8,8,1 |
| 20 (कैल्सियम) | 2,8,8,2 |
| 21 | 2,8,8,3 |
| 38 | 2,8, 18, 8,2 |
हम पाते हैं कि परमाणु संख्या 12 व 38 वाले तत्वों के इलेक्ट्रॉनिक विन्यास कैल्सियम से मिलते-जुलते हैं और इसलिए इनके भौतिक व रासायनिक गुणधर्म भी समान होते हैं।
प्रश्न 10.
आधुनिक आवर्त सारणी एवं मेन्डेलीफ की आवर्त सारणी में तत्वों की व्यवस्था की तुलना कीजिए।
उत्तर-
1. मेन्डेलीफ की आवर्त सारणी के समय 63 ज्ञात तत्व थे परन्तु आधुनिक आवर्त सारणी में 114 ज्ञात तत्व
2. मेन्डेलीफ की आवर्त सारणी में कुछ तत्वों के लिए स्थान खाली छोड़ दिए गए थे जो कि उस समय ज्ञात नहीं थे परन्तु अब आधुनिक आवर्त सारणी में सभी तत्व भली-भाँति व्यवस्थित हैं।
3. मेन्डेलीफ की आवर्त सारणी में कोबाल्ट व निकल तथा टेलुरियम व आयोडीन गलत रखे गये थे, परन्तु आधुनिक आवर्त सारणी में नियमानुसार वे सही क्रम में व्यवस्थित हैं।
4. मेन्डेलीफ की आवर्त सारणी का आधार द्रव्यमान है .. जबकि आधुनिक आवर्त सारणी का आधार परमाणु क्रमांक है। अत: मेन्डेलीफ की आवर्त सारणी में तत्व परमाणु द्रव्यमानों के वृद्धि क्रम में रखे हुए हैं, जबकि आधुनिक सारणी में तत्व परमाणु क्रमांक के वृद्धि क्रम में रखे गए हैं।
5. मेन्डेलीफ की आवर्त सारणी में 9 ऊर्ध्वाधर स्तम्भ हैं जिन्हें समूह कहते हैं, जबकि आधुनिक आवर्त सारणी में 18 ऊर्ध्वाधर स्तम्भ हैं जिन्हें समूह कहते हैं।
![]()
HBSE 10th Class Science तत्वों का आवर्त वर्गीकरण InText Questions and Answers
(पाठ्य-पुस्तक पृ.सं.91)
प्रश्न 1.
क्या डॉबेराइनर के त्रिक, न्यूलैंड्स के अष्टक के स्तम्भ में भी पाए जाते हैं ? तुलना करके पता कीजिए।
उत्तर-
हाँ, डॉबेराइनर के त्रिक न्यूलैंड्स के अष्टक के स्तम्भ में भी पाए जाते हैं। उदाहरण के लिए
- त्रिक-Li, Na तथा K न्यूलैंड्स अष्टकों के ‘रे’ स्तम्भ में उपस्थित हैं।
- त्रिक-Ca, Sr तथा Ba न्यूलैंड्स के अष्टक के ‘गा’ स्तम्भ में उपस्थित हैं।
प्रश्न 2.
डॉबेराइनर के वर्गीकरण की क्या सीमाएँ हैं?
उत्तर-
डॉबेराइनर के वर्गीकरण की सीमाओं के रूप में यह वर्गीकरण उस समय ज्ञात तत्वों में से केवल तीन त्रिकों को निर्धारित करने में सफल रहा। अतः यह वर्गीकरण
प्रश्न 3.
न्यूलैंड्स के अष्टक सिद्धान्त की क्या सीमाएँ
उत्तर-
न्यूलैंड्स के अष्टक नियम की निम्नलिखित सीमाएँ हैं-
1. यह वर्गीकरण केवल कैल्सियम तक ही मान्य हो पाया क्योंकि कैल्सियम के बाद प्रत्येक आठवें तत्व का गुणधर्म पहले तत्व से नहीं मिलता था। .
2. बाद में खोजे गए अनेक तत्व अष्टक नियम के अनुसार इसमें व्यवस्थित न हो सके।
3. इसमें कुछ असमान तत्वों को एक स्तर के अन्तर्गत रखा गया था। उदाहरण के लिए, कोबाल्ट तथा निकल को एक ही स्थान पर रखा गया परन्तु इन्हें फ्लुओरीन, क्लोरीन तथा ब्रोमीन के साथ एक ही स्तम्भ ‘सा’ के अन्तर्गत रखा गया है जबकि कोबाल्ट तथा निकल के गुण फ्लुओरीन, क्लोरीन तथा ब्रोमीन से सर्वथा भिन्न हैं।
(पाठ्य-पुस्तक पृ. सं. 94).
प्रश्न 1.
मेन्डेलीफ की आवर्त सारणी का उपयोग कर निम्नलिखित तत्वों के ऑक्साइड के सूत्र का अनुमान दीजिए- K,C,Al, Si, Ba
उत्तर –
| तत्व | ऑक्साइडों के सूत्र |
| K, | K2O |
| C | CO2 |
| Al | Al2O3 |
| Si | SiO2 |
| Ba | BaO |
प्रश्न 2.
गैलियम के अतिरिक्त, अब तक कौन-कौन से तत्वों का पता चला है जिसके लिए मेन्डेलीफ ने अपनी आवर्त सारणी में खाली स्थान छोड़ दिया था? दो उदाहरण दीजिए।
उत्तर-
जर्मेनियम (Ge) तथा पोलोनियम (Po) वर्ग IVA के दो तत्व हैं। इन दोनों तत्वों के लिए भी मेन्डेलीफ ने अपनी आवर्त सारणी में खाली स्थान छोड़ा था। इन तत्वों की बाद में खोज होने पर इनके गुणधर्म मेन्डेलीफ के बताए गुणधर्म से मिलते हैं।
प्रश्न 3.
मेन्डेलीफने अपनी आवर्त सारणी तैयार करने के लिए कौन सा मानदण्ड अपनाया?
उत्तर-
मेन्डेलीफ ने अपनी आवर्त सारणी में तत्वों को उनके मूल गुणधर्म, परमाणु द्रव्यमान तथा रासायनिक गुणधर्मों में समानता के आधार पर व्यवस्थित किया।
प्रश्न 4.
आपके अनुसार उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया?
उत्तर-
सभी तत्वों में से उत्कृष्ट गैसें, जैसे-हीलियम (He), नीऑन (Ne), आर्गन (Ar), क्रिप्टॉन (Kr) तथा जीनॉन (Xe), सबसे अधिक अक्रियाशील हैं। ये अन्य तत्वों से अभिक्रिया नहीं करते, इसलिए मेन्डेलीफ ने उन्हें अलग वर्ग में रखा जिसे उन्होंने शून्य वर्ग कहा।
(पाठ्य-पुस्तक पृ. सं. 100)
प्रश्न 1.
आधुनिक आवर्त सारणी द्वारा किस प्रकार से मेन्डेलीफ की आवर्त सारणी की विविध विसंगतियों को दूर किया गया?
उत्तर-
सन् 1913 में हेनरी मोजले ने बताया कि परमाणु का आधारभूत गुण परमाणु क्रमांक है न कि परमाणु भार । इसके द्वारा आधुनिक आवर्त सारणी का निर्माण किया गया तथा इस सारणी द्वारा मेन्डेलीफ की सारणी के निम्न दोषों को दूर किया गया-
- आधुनिक आवर्त सारणी में सभी समस्थानिकों को एक ही स्थान दिया गया क्योंकि इनके परमाणु क्रमांक एकसमान होते हैं।
- आर्गन तथा पोटैशियम की परमाणु संख्या क्रमश: 18 एवं 19 है। तत्वों की बढ़ती परमाणु संख्या के आधार पर व्यवस्थित करने पर आर्गन पहले आता है, जबकि उनके परमाणु द्रव्यमान इसके विपरीत हैं। आधुनिक आवर्त सारणी में इस दोष को दूर किया गया है।
- सभी मृदा तत्वों को एक ही स्थान पर रखा गया है क्योंकि इनकी बाह्यतम कक्षा में इलेक्ट्रॉनों की संख्या समान है।
![]()
प्रश्न 2.
मैग्नीशियम की तरह रासायनिक अभिक्रियाशीलता दिखाने वाले दो तत्वों के नाम लिखिए। आपके चयन का क्या आधार है?
उत्तर-
मैग्नीशियम की तरह रासायनिक अभिक्रिया शीलता दिखाने वाले दो तत्व बेरीलियम तथा कैल्सियम हैं। . आधुनिक आवर्त सारणी के अनुसार, “जिन तत्वों का बाहरी इलेक्ट्रॉनिक विन्यास समान होता है उनके गुणधर्म भी समान होते हैं। मैग्नीशियम के बाहरी कोश में 2 इलेक्ट्रॉन हैं अत: वे सभी तत्व जिनके बाहरी कोश में 2 इलेक्ट्रॉन होंगे Mg के समान ही गुणधर्म प्रदर्शित करेंगे।
प्रश्न 3.
निम्नलिखित प्रकृति वाले तत्वों के नाम बताइए –
(a) तीन तत्व जिनके सबसे बाहरी कोश में एक इलेक्ट्रॉन उपस्थित हो।
(b) दो तत्व जिनके सबसे बाहरी कोश में दो इलेक्ट्रॉन उपस्थित हों।
(c) तीन तत्व जिनका बाहरी कोश पूर्ण हो।
उत्तर-
(a) लीथियम, सोडियम, पोटैशियम।
(b) मैग्नीशियम, कैल्सियम।
(c) हीलियम, नीऑन, आर्गन।
प्रश्न 4.
(a) लीथियम, सोडियम, पोटैशियम ये सभी धातुएँ जल से अभिक्रिया करके हाइड्रोजन गैस मुक्त करती हैं। क्या इन तत्वों के परमाणुओं में कोई समानता है?
(b) हीलियम एक अक्रियाशील गैस है जबकि नीऑन की अभिक्रियाशीलता अत्यन्त कम है। इनके परमाणुओं में कोई समानता है?
उत्तर-
(a) लीथियम, सोडियम, पोटैशियम समूह से सम्बन्धित हैं। इन सभी तत्वों के परमाणुओं के बाह्यतम कोश में एक इलेक्ट्रॉन होता है।
(b) हीलियम तथा नीऑन दोनों अक्रिय गैसें हैं तथा इनके बाह्यतम कक्ष पूर्ण हैं।
प्रश्न 5.
आधुनिक आवर्त सारणी में पहले दस तत्वों में कौन-सी धातुएँ हैं?
उत्तर-
पहले दस तत्व हैं-
H. He, Li. Be: B.C, N.O. F तथा Ne इन सभी तत्वों में से धातु हैं – Li तथा Be
प्रश्न 6.
आवर्त सारणी में इनके स्थान के आधार पर इनमें से किस तत्व में सबसे अधिक धात्विक अभिलक्षण की विशेषता है?
Ga Ge As Se Be
उत्तर-
Ga; चूँकि धात्विक गुण बाएँ से दाएँ घटता है। दिए गए तत्वों की आवर्त सारणी में ऐसी स्थिति के अनुसार Ga धातु है, Ge तथा AS उपधातु हैं तथा Se, Be अधातु हैं। स्पष्ट है Ga में धात्विक गण सर्वाधिक है।
HBSE 10th Class Science तत्वों का आवर्त वर्गीकरण InText Activity Questions and Answers
क्रियाकलाप 5.1 (पा. पु. पृ. सं. 94)
प्रश्न-क्षार धातुओं एवं हैलोजेन कुल की समानता को ध्यान में रखते हुए हाइड्रोजन को मेन्डेलीफ की आवर्त सारणी में उचित स्थान पर रखिए। हाइड्रोजन को किस समूह एवं आवर्त में रखना चाहिए?
उत्तर-
मेन्डेलीफ की आवर्त सारणी में हाइड्रोजन को नियत स्थान नहीं दिया जा सकता क्योंकि हाइड्रोजन, ऑक्सीजन एवं सल्फर के साथ एक सूत्र वाले यौगिक बनाती है। दूसरी ओर हाइड्रोजन द्विपरमाणुक अणु के रूप में भी पायी जाती हैं।
![]()
क्रियाकलाप 5.2 (पा. पु. पृ.सं. 94)
प्रश्न –
क्लोरीन के समस्थानिक Cl-35 व Cl-37 के परमाणु क्रमांक भिन्न-भिन्न होने के कारण क्या आप उन्हें अलग-अलग रखेंगे? या रासायनिक गुणधर्म समान होने के कारण आप दोनों को एक ही स्थान पर रखेंगे?
उत्तर-
सभी तत्वों के समस्थानिक मेन्डेलीफ के आवर्त नियम के लिए एक चुनौती थी तथा समस्या यह थी कि एक तत्व से दूसरे तत्व की ओर आगे बढ़ने पर परमाणु द्रव्यमान नियमित रूप से नहीं बढ़ते हैं। इसलिए यह अनुमान लगाना कठिन हो गया कि दो तत्वों के बीच कितने तत्व खोजे जा सकते हैं। मेन्डेलीफ के आवर्त नियमानुसार इन्हें इनकी सारणी में स्थान देना चाहिए था परन्तु रासायनिक गुणधर्म के समान होने के कारण ये एक ही स्थान पर रखे जायेंगे। आधुनिक आवर्त सारणी में यह समस्या दूर हो गयी थी क्योंकि इसे परमाणु क्रमांकों के बढ़ते क्रम के आधार पर बनाया गया था।
क्रियाकलाप 5.3 (पा. पु. पृ. सं. 95)
प्रश्न 1.
आधुनिक आवर्त सारणी में कोबाल्ट एवं निकल के स्थान कैसे निर्धारित किए गए हैं?
2. आधुनिक आवर्त सारणी में विभिन्न तत्वों के समस्थानिकों का स्थान कैसे सुनिश्चित किया गया
3. क्या 1.5 परमाणु संख्या वाले किसी तत्व को हाइड्रोजन एवं हीलियम के बीच रखा जा सकता
4. आपके अनुसार आवर्त सारणी में हाइड्रोजन को – कहाँ रखना चाहिए? –
उत्तर-
(1) कोबाल्ट का परमाणु क्रमांक 27 एवं निकिल · का परमाणु क्रमांक 28 है। आधुनिक आवर्त नियम के अनुसार आवर्त सारणी में तत्वों को बढ़ते हुए परमाणु क्रमांक के क्रम में रखा जाता है। अतः कम परमाणु क्रमांक वाला तत्व कोबाल्ट पहले तथा अधिक परमाणु क्रमांक वाला तत्व निकिल बाद में आएगा। पूर्व में परमाणु भार के आधार पर ये दोनों तत्व गलत क्रम में व्यवस्थित थे क्योंकि कोबाल्ट का परमाणु भार 58.93 तथा निकिल का परमाणु भार 58.71 है।
(2) आधुनिक आवर्त नियम के अनुसार एक ही तत्व के सभी समस्थानिकों का परमाणु क्रमांक एक समान होता है – अतः इन्हें एक ही स्थान पर रखा गया है जो कि उचित है। .
(3) 1.5 परमाणु क्रमांक वाला तत्व हाइड्रोजन व हीलियम के बीच स्थित नहीं हो सकता।
(4) हाइड्रोजन परमाणु पहले समूह के तत्वों की तरह एक इलेक्ट्रॉन खोकर तथा सातवें समूह के तत्वों की तरह एक इलेक्ट्रॉन ग्रहण करके संयोजन करता है, अतः इसको प्रथम तथा सप्तम समूह में रखना ठीक है।
क्रियाकलाप 5.4 (पा. पु. पृ. सं. 95)
प्रश्न 1.
आधुनिक आवर्त सारणी के समूह –
1. में उपस्थित तत्वों के नाम बताइए।
2. समूह के पहले तीन तत्वों के इलेक्ट्रॉनिक विन्यास लिखिए।
3. इन तत्वों के इलेक्ट्रॉनिक विन्यास में क्या समानता
4. इन तीनों तत्वों में कितने संयोजकता इलेक्ट्रॉन
उत्तर-
1. हाइड्रोजन (H), लीथियम (Li), सोडियम (Na), पोटैशियम (K), रूबीडियम (Rb), कैल्सियम (Ca), फ्रान्शियम (Fr)।
2. प्रथम तीन तत्वों के इलेक्ट्रॉनिक विन्यास –
हाइड्रोजन (H) =1
लीथियम (Li)=2,1
सोडियम (Na)= 2,8,1 3.
3. इनके सबसे बाहरी कोश में इलेकनों की संख्या समान (प्रत्येक में 1) है। अतः इनके संयोजी इलेक्ट्रॉनों की संख्या भी समान है।
4. एक संयोजी इलेक्ट्रॉन।
क्रियाकलाप 5.5 (पा. पु. पृ. सं.97)
प्रश्न
1. यदि आप आवर्त सारणी के लम्बे रूप को देखें . तो आपको पता चलेगा कि Li, Be, B, C,N,O, F तथा Ne दूसरे आवर्त के तत्व हैं। इनके इलेक्ट्रॉनिक विन्यास लिखिए।
2. क्या इन सभी तत्वों के भी संयोजकता इलेक्ट्रॉनों . की संख्या समान है।
3. क्या इनके कोशों की संख्या समान है।
उत्तर-
1.
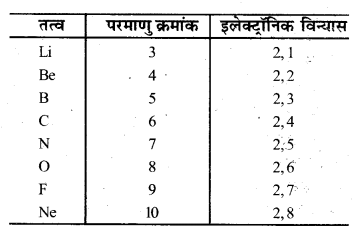
2. नहीं, सभी में असमान हैं।
3. हाँ, सभी में समान हैं। ‘
क्रियाकलाप 5.6 (पा. पु. पृ. सं.98)
प्रश्न 1.
किसी तत्व के इलेक्ट्रॉनिक विन्यास से आप उसकी संयोजकता का परिकलन कैसे करेंगे?
2. परमाणु संख्या 12 वाले मैग्नीशियम तथा परमाणु संख्या 16 वाले सल्फर की संयोजकता क्या है?
3. इसी प्रकार पहले 20 तत्वों की संयोजकताएँ ज्ञात कीजिए।
4. आवर्त में बाईं से दाईं ओर जाने पर संयोजकता किस प्रकार परिवर्तित होती है?
5. समूह में ऊपर से नीचे जाने पर संयोजकता किस – प्रकार परिवर्तित होती है?
उत्तर-
1. यदि तत्वों के परमाणुओं के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या 1, 2, 3 या 4 है तो उन तत्वों की संयोजकताएँ क्रमश: 1, 2, 3 तथा 4 होंगी। ..यदि तत्वों के परमाणुओं के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या 5, 6 या 7 है तो उन तत्वों की संयोजकताएँ क्रमश: 3,2, 1 होंगी। यदि तत्वों के परमाणुओं के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या 8 है तो उन तत्वों की संयोजकता शृन्य (0) होगी।
2. मैग्नीशियम का इलेक्ट्रॉनिक विन्यास 2, 8, 2 है, अतः इसकी संयोजकता 2 है। सल्फर का इलेक्ट्रॉनिक विन्यास 2, 8, 6 है, अत: इसकी संयोजकता 2 है।
3. आवर्त सारणी के प्रथम बीस तत्वों की ‘वयोजकताएँ निम्नलिखित है-
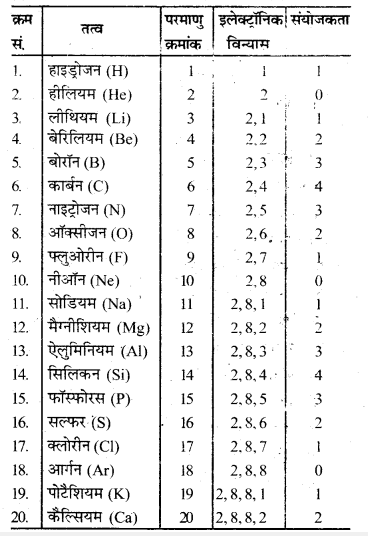
4. आवर्त में बाएँ से दाएँ जाने पर संयोजकता पहले 1 से 4 तक बढ़ती है फिर 1 तक घटकर उत्कृष्ट गैस की स्थिति में शून्य हो जाती है।
5. समूह में सभी तत्वों की संयोजकताएँ समान होती है।
![]()
क्रियाकलाप 5.7 (पा.पु. पृ.सं.98)
प्रश्न-
आधुनिक आवर्त सारणी का अध्ययन कर दिये गये प्रश्नों का उत्तर देना। दूसरे आवर्त के तत्वों की परमाणु त्रिज्याएँ नीचे दी गई हैं-
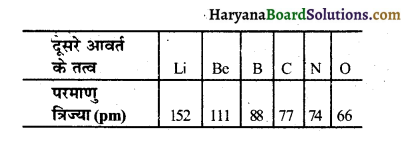
1. इन्हें परमाणु त्रिज्या के अवरोही क्रम में व्यवस्थित – कीजिए।
2. क्या ये तत्व अब आवर्त सारणी के आवर्त की – तरह ही व्यवस्थित हैं?
3. किस तत्व का परमाणु सबसे बड़ा एवं किसका . सबसे छोटा है?
4. आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या .. किस प्रकार बदलती है?
उत्तर-
1. अवरोही क्रम
2. हाँ, ये आवर्त सारणी के आवर्त की भाँति व्यवस्थित
3. लीथियम का परमाणु सबसे बड़ा तथा ऑक्सीजन का सबसे छोटा है। 4. परमाणु त्रिज्या, आवर्त में बाएँ से दाएँ जाने पर घटती है।
क्रियाकलाप 5.8 (पा. पु. पृ. सं. 99)
प्रश्न 1.
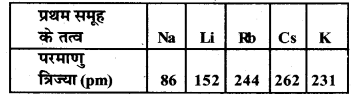
प्रथम समूह के तत्वों की परमाणु त्रिज्या में परिवर्तन का अध्ययन कीजिए तथा उन्हें आरोही
क्रम में व्यवस्थित कीजिए। प्रथम समूह के तत्व
Na | Li] Rs |Cs | K परमाणु त्रिज्या (pm) | 86 | 152| 244 262|231
2. किस तत्व का परमाणु सबसे छोटा तथा किसका सबसे बड़ा है?
3. समूह में ऊपर से नीचे जाने पर परमाणु आकार में परिवर्तन किस प्रकार होगा?
उत्तर-
1. परमाणु त्रिज्या का आरोही क्रम निम्नवत्
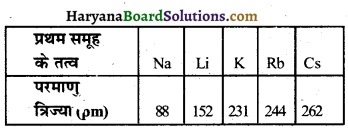
2. सोडियम (Na) के परमाणु सबसे छोटे तथा सीजियम (Cs) के परमाणु सबसे बड़े हैं।
3. समूह में ऊपर से नीचे जाने पर परमाणु त्रिज्या बढ़ती है। इसका कारण यह है कि नीचे जाने पर एक नया कोश जुड़ जाता है, इससे नाभिक तथा सबसे बाहरी कोश के बीच की दूरी बढ़ जाती है और इस कारण नाभिक का आवेश बढ़ जाने के बाद भी परमाणु का आकार बढ़ जाता है।
क्रियाकलाप 5.9 (पा. पु. पृ.सं. 99)
प्रश्न 1.
तीसरे आवर्त के तत्वों की जाँच कर उन्हें धातु एवं अधातु में वर्गीकृत करें।
2. सारणी के किस ओर धातएं स्थित है?
3. सारणी के किस ओर अधातुएं स्थित हैं?
उत्तर-
1. तीसरे आवर्त में Na. Mg व AI धातुएँ हैं तथा P, S, CIव Ar अधातुएँ हैं।
2. सारणी में तिरछी रेखा के बाईं ओर धातुएँ स्थित हैं।
3. सारणी में तिरछी रेखा के दाईं ओर अधातुएँ स्थित हैं।
क्रियाकलाप 5.10 (पा.पु. पृ. सं. 99)
प्रश्न – समूह में इलेक्ट्रॉन त्यागने की प्रवृत्ति किस प्रकार बदलती है? आवर्त में यह प्रवृत्ति कैसे बदलेगी?
उत्तर-
आवर्त में जैसे-जैसे संयोजकता कोश के इलेक्ट्रॉनों पर क्रिया करने वाला प्रभावी नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉन त्यागने की प्रवृत्ति घट जाती है। समूह में नीचे की ओर, संयोजकता इलेक्ट्रॉन पर क्रिया करने वाला प्रभावी नाभिकीय आवेश घटता है। बाहरी इलेक्ट्रॉन नाभिक से सुगमतापूर्वक निकल जाते हैं, अतः धात्विक अभिलक्षण आवर्त में घटता है तथा समूह में नीचे जाने पर धात्विक अभिलक्षण में वृद्धि होती है। अधातुएँ विद्युत ऋणात्मक होती हैं, उनमें इलेक्ट्रॉन ग्रहण करके आबन्ध बनाने की प्रवृत्ति होती है।
![]()
क्रियाकलाप 5.11 (पा. पु. पृ. सं. 100)
प्रश्न-
आवर्त में बाईं से दाईं ओर जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होती है तथा समूह में ऊपर से नीचे जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी?
उत्तर-
किसी आवर्त में बाईं से दाईं ओर जाने पर इलेक्ट्रॉन बन्धुता या इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बढ़ती है। किसी समूह में ऊपर से नीचे आने पर इलेक्ट्रॉन बन्धुता घटती है।