Haryana State Board HBSE 9th Class Science Solutions Chapter 4 परमाणु की संरचना Textbook Exercise Questions and Answers.
Haryana Board 9th Class Science Solutions Chapter 4 परमाणु की संरचना
HBSE 9th Class Science परमाणु की संरचना Intext Questions and Answers
(पृष्ठ संख्या-53)
प्रश्न 1.
केनाल किरणें क्या हैं?
उत्तर:
ई० गोल्डस्टीन ने 1886 ई० में धनावेशित विकिरण की खोज की, जिन्हें केनाल किरणें कहा जाता है।
प्रश्न 2.
यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
उत्तर:
यदि किसी परमाणु में एक इलेक्ट्रॉन व एक प्रोटॉन हो तो उस पर कोई आवेश नहीं होगा क्योंकि प्रोटॉन और इलेक्ट्रॉन परस्पर आवेशों को संतुलित करते हैं।
(पृष्ठ संख्या -56)
प्रश्न 1.
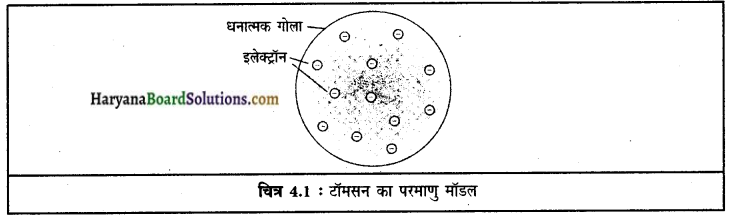
परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर:
टॉमसन के मॉडल अनुसार परमाणु धन आवेशित गोले का बना होता है तथा इलेक्ट्रॉन उसमें धंसे होते हैं। इस प्रकार ऋणात्मक और धनात्मक आवेश परिमाण समान होने के कारण परमाणु वैद्युतीय रूप से उदासीन होता है।
प्रश्न 2.
रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सा अवपरमाणुक कण विद्यमान है?
उत्तर:
रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में प्रोटॉन अवपरमाणुक कण विद्यमान है क्योंकि वह अल्फा कण को विक्षेपित करता है।
प्रश्न 3.
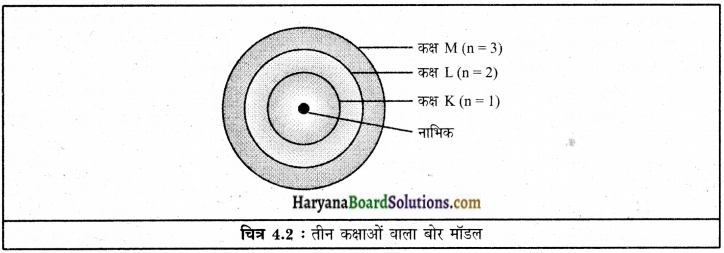
तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
उत्तर
प्रश्न 4.
क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
उत्तर:
हाँ, अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त किसी भी दूसरी धातु की पन्नी से संभव होगा।
![]()
(पृष्ठ संख्या – 56)
प्रश्न 1.
परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर:
परमाणु के तीन अवपरमाणुक कण इलेक्ट्रॉन, प्रोटॉन व न्यूटॉन हैं।
प्रश्न 2.
हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
उत्तर:
हीलियम परमाणु का परमाणु द्रव्यमान = 4u
हीलियम के परमाणु नाभिक में उपस्थित प्रोटॉन = 2
हीलियम के परमाणु नाभिक में उपस्थित न्यूट्रॉन = परमाणु द्रव्यमान – प्रोटॉन
= 4 – 2 = 2
(पृष्ठ संख्या-57)
प्रश्न 1.
कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन-वितरण लिखिए।
उत्तर:
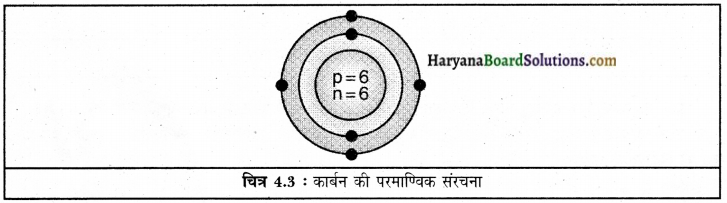
1. कार्बन
द्रव्यमान संख्या = 12
परमाणु संख्या = 6
इसलिए प्रोटॉनों की संख्या = 6
इलेक्ट्रॉनों की संख्या = 6
न्यूट्रॉनों की संख्या = 12 – 6 = 6
इलेक्ट्रॉन वितरण = K = 2, L=4
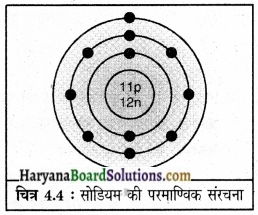
2. सोडियम
द्रव्यमान संख्या = 23
परमाणु संख्या = 11
इसलिए प्रोटॉनों की संख्या = 11
इलेक्ट्रॉनों की संख्या = 11
न्यूट्रॉनों की संख्या = 23 – 11 = 12
इलेक्ट्रॉन वितरण = K = 2
L = 8
M = 1
![]()
प्रश्न 2.
अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी? उत्तर
कोश K = 2 इलेक्ट्रॉन
कोश L = 8 इलेक्ट्रॉन
अतः परमाणु में कुल इलेक्ट्रॉन = 2 + 8 = 10 इलेक्ट्रॉन .
(पृष्ठ संख्या-58)
प्रश्न 1.
क्लोरीन, सल्फर और मैग्नीशियम की परमाणु संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे?
उत्तर:
(1) क्लोरीन की परमाणु संख्या 17 है इसलिए इसका इलेक्ट्रॉन वितरण निम्न होगा
K = 2 इलेक्ट्रॉन
L = 8 इलेक्ट्रॉन
M = 7 इलेक्ट्रॉन
इस प्रकार क्लोरीन को अपना अष्टक पूरा करने के लिए (8-7) = 1 इलेक्ट्रॉन की आवश्यकता है। अतः क्लोरीन की संयोजकता 1 है।
(2) सल्फर की परमाणु संख्या 16 है इसलिए इसका इलेक्ट्रॉन वितरण निम्न होगा
K = 2 इलेक्ट्रॉन
L = 8 इलेक्ट्रॉन
M = 6 इलेक्ट्रॉन
इस प्रकार सल्फर को अपना अष्टक पूरा करने के लिए (8 – 6) = 2 इलेक्ट्रॉनों की आवश्यकता है। अतः सल्फर की संयोजकता 2 है।
(3) मैग्नीशियम की परमाणु संख्या 12 है। इसलिए इसका इलेक्ट्रॉन वितरण निम्न होगा
K = 2 इलेक्ट्रॉन
L = 8 इलेक्ट्रॉन
M = 2 इलेक्ट्रॉन
इस प्रकार मैग्नीशियम को अपना बाह्य अष्टक पूरा करने के लिए 2 इलेक्ट्रॉनों को त्यागना आसान है। अतः मैग्नीशियम की संयोजकता 2 है।
![]()
(पृष्ठ संख्या – 59)
प्रश्न 1.
यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणु का क्या आवेश है?
उत्तर:
परमाणु में इलेक्ट्रॉनों की संख्या = 8
परमाणु में प्रोटॉनों की संख्या = 8
परमाणु में प्रोटॉनों की संख्या = इलेक्ट्रॉनों की संख्या
= 8
(a) परमाणु की परमाणुक संख्या = परमाणु में प्रोटॉनों तथा इलेक्ट्रॉन की संख्या
= 8 + 8 = 16
(b) इलेक्ट्रॉन वितरण = K = 2, L = 6
अतः परमाणु के बाह्यतम कोश को पूरा करने के लिए 2 इलेक्ट्रॉनों की आवश्यकता है। इसलिए आवेश -2 है।
प्रश्न 2.
पाठ्यपुस्तक की सारणी 4.1 की सहायता से ऑक्सीजन और सल्फर-परमाणु की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर:
दी गई सारणी अनुसार
(1) ऑक्सीजन में परमाणु संख्या = 8
ऑक्सीजन में प्रोटॉनों की संख्या = 8
ऑक्सीजन में न्यूट्रॉनों की संख्या = 8
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 8 + 8 = 16
(2) सल्फर में परमाणु संख्या = 16
सल्फर में प्रोटॉनों की संख्या = 16
सल्फर में न्यूट्रॉनों की संख्या = 16
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 16 + 16 = 32
(पृष्ठ संख्या – 60)
प्रश्न 1.
चिह्न H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
उत्तर:
(1) चिह्न H प्रोटियम का प्रतीक है अर्थात ,\({ }_1 \mathrm{H}^1\)
परमाणु संख्या = 1
द्रव्यमान संख्या = 1
इलेक्ट्रॉनों की संख्या = 1
प्रोट्रॉनों की संख्या = 1
न्यूट्रॉनों की संख्या = 1 – 1 = 0
(2) चिह्न D ड्यूटीरियम का प्रतीक है अर्थात \({ }_1 \mathrm{H}^2\)
परमाणु संख्या = 1
द्रव्यमान संख्या = 2
इलेक्ट्रॉनों की संख्या = 1
प्रोट्रॉनों की संख्या = 1
न्यूट्रॉनों की संख्या = 2 – 1 = 1
(3) चिह्न T ट्राइटियम का प्रतीक है अर्थात \({ }_1 \mathrm{H}^3\)
परमाणु संख्या = 1
द्रव्यमान संख्या = 3
इलेक्ट्रॉनों की संख्या = 1
प्रोट्रॉनों की संख्या = 1
न्यूट्रॉनों की संख्या = 3 – 1 = 2
![]()
प्रश्न 2.
समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
(i) समस्थानिक युग्म क्लोरीन \({ }_{17} \mathrm{Cl}^{35}\) व \({ }_{17} \mathrm{Cl}^{37}\) का इलेक्ट्रॉनिक विन्यास निम्नलिखित होगा

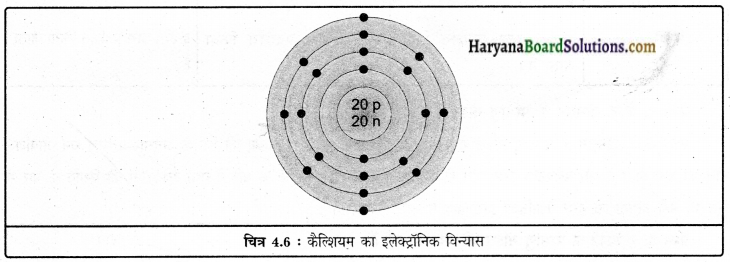
(ii) समभारिक युग्म कैल्शियम तथा आर्गन का इलेक्ट्रॉनिक विन्यास निम्न होगा
(1) कैल्शियम \({ }_{20} \mathrm{Cl}^{40}\)
e = 20
P = 20
N = 40 – 20 – 20
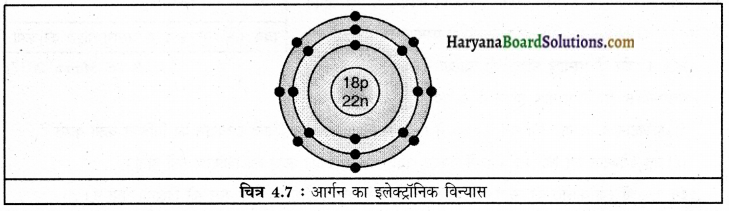
(2) आर्गन 18Ar40
e = 18
P = 18
N = 40 – 18 = 22
HBSE 9th Class Science परमाणु की संरचना Textbook Questions and Answers
प्रश्न 1.
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर:
| गुण | इलेक्ट्रॉन | प्रोटॉन | न्यूट्रॉन |
| 1. आवेश | इन पर इकाई \(\left(-1.6 \times 10^{-19} \mathrm{C}\right)\) ऋण आवेश होता है। | इन पर इकाई \(\left(+1.6 \times 10^{-19} \mathrm{C}\right)\) धन आवेश होता है। | इन पर कोई आवेश नहीं होता। |
| 2. द्रव्यमान | इनका द्रव्यमान हाइड्रोजन के परमाणु के द्रव्यमान का \(\frac{1}{2000}\) वां भाग होता है। | इनका द्रव्यमान हाइड्रोजन के परमाणु के द्रव्यमान के \(\left(1.674 \times 10^{-24} \mathrm{~g}\right)\) समान होता है । | इनका द्रव्यमान भी हाइड्रोजन के परमाणु के द्रव्यमान के \(\left(1.674 \times 10^{-24} \mathrm{~g}\right)\) समान होता है। |
| 3. स्थिति | ये नाभिक के चारों ओर निश्चित वृत्ताकार कोशों में चक्कर लगाते हैं। | ये नाभिक में स्थित होते हैं। | ये कण भी नाभिक में स्थित होते हैं। |
| 4. संकेत | इन्हें e द्वारा प्रदशित किया जाता है। | इन्हें p द्वारा प्रदर्शित किया जाता है। | इन्हें \(\mathrm{n}\) द्वारा प्रदर्शित किया जाता है। |
प्रश्न 2.
जे.जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर:
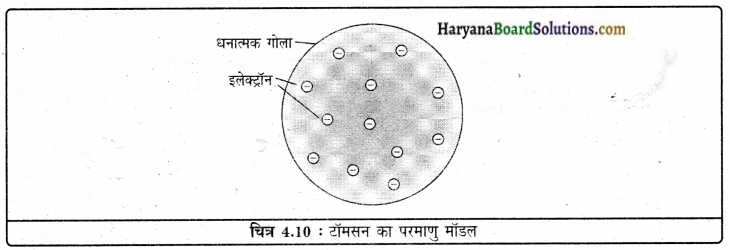
जे.जे. टॉमसन के परमाणु मॉडल ने परमाणु के उदासीन होने की व्याख्या की जिसके अनुसार परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धंसे होते हैं, परंतु यह मॉडल न्यूट्रॉनों के बारे में तथा इलेक्ट्रॉनों की स्थिति के बारे में कुछ भी नहीं बताता जो दूसरे वैज्ञानिकों द्वारा बाद में स्पष्ट किया गया।
![]()
प्रश्न 3.
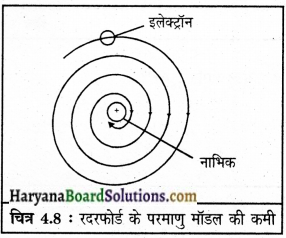
रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर:
अरनेस्ट रदरफोर्ड के परमाणु मॉडल की मुख्य सीमा यह थी कि यह परमाणु की स्थिरता का वर्णन नहीं करता। उसके मॉडल अनुसार, इलेक्ट्रॉन नाभिक के चारों ओर वृत्तीय पथ में चक्कर काटते हैं जिसका परिणाम उनकी त्वरित गति होता है। अतः यह ऊर्जा को विकरित करके वृत्तीय पथ के नाभिक आकार को छोटा कर देगा। परिणामस्वरूप इलेक्ट्रॉन नाभिक में गिर जाएँगे और परमाणु को अस्थिर कर देंगे, परंतु वास्तव में परमाणु अस्थिर नहीं है। चित्र 4.8 : रदरफोर्ड के परमाणु मॉडल की कमी
प्रश्न 4.
बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर:
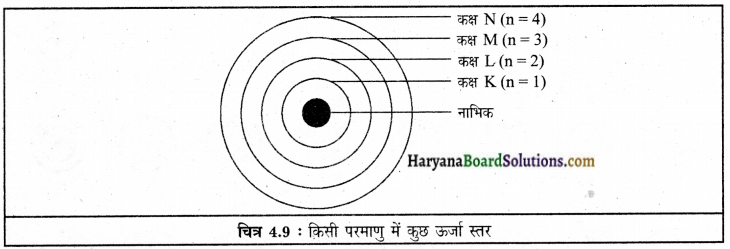
नील्स बोर के परमाणु मॉडल के अनुसार
(1) इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं।
(2) जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का विकिरण नहीं होता। इन कक्षाओं (या कोशों) को ऊर्जा-स्तर कहते हैं। चित्र में एक परमाणु के ऊर्जा स्तर को दिखाया गया है।
प्रश्न 5.
इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर:
इस अध्याय में दिए गए विभिन्न परमाणु मॉडलों की तुलना निम्नलिखित प्रकार से हैं-
1. टॉमसन के परमाणु मॉडल अनुसार
(1) परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धंसे होते हैं।
(2) ऋणात्मक और धनात्मक आवेश परिणाम में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
2. रदरफोर्ड के परमाणु मॉडल अनुसार
(1) परमाणु का केंद्र धनावेशित होता है जिसे नाभिक कहा जाता है। एक परमाणु का लगभग संपूर्ण द्रव्यमान नाभिक में होता है।
(2) इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं में चक्कर लगाते हैं।
(3) नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है।
3. बोर मॉडल के अनुसार
(1) इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं।
(2) जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का विकिरण नहीं होता है। इन कक्षाओं को ऊर्जा स्तर कहते हैं।
![]()
प्रश्न 6.
पहले अठारह तत्त्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए।
उत्तर:
पहले अठारह तत्त्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के लिए बोर और बरी द्वारा निम्न नियम प्रस्तुत किए गए
(1) किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या को सूत्र 2n2 से दर्शाया जाता है, जहाँ ‘n’ कक्ष की संख्या या ऊर्जा स्तर है। इसलिए इलेक्ट्रॉनों की अधिकतम संख्या पहले कक्ष या K कोश में (2 x 12) = 2 होगी, दूसरे कक्ष या L सेल में (2 x 22) = 8 होगी, तीसरे कक्ष या M सेल में होगी = (2 x 32)= 18, चौथे कक्ष या N सेल में होगी = (2 x 42)= 32.
(2) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
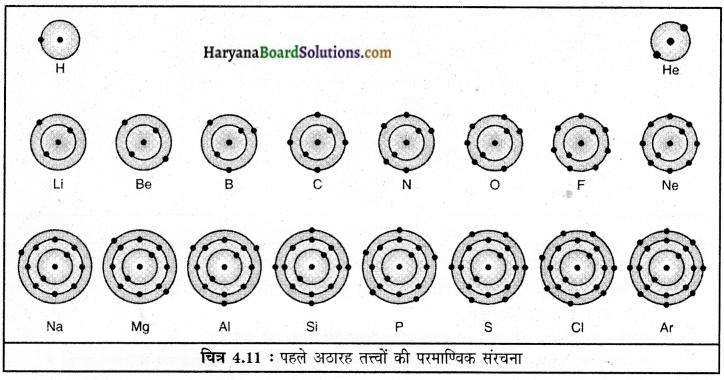
(3) किसी परमाणु के अगले कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कोश पूर्ण रूप से भर नहीं जाता। इससे स्पष्ट होता है कि कक्षाएँ क्रमानुसार भरती हैं।
प्रश्न 7.
सिलिकॉन और ऑक्सीजन का उदाहरण देते हुए संयोजकता की परिभाषा दीजिए।
उत्तर:
परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों के अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानांतरण होता है, वह उस तत्त्व की संयोजकता कहलाती है। जैसे
(1) सिलिकॉन \(({ }_{14} \mathrm{Si}^{28})\) में इलेक्ट्रॉनों का वितरण निम्न होगा
K = 2
L = 8
M = 4
अतः यह अपना अष्टक पूरा करने के लिए 4 इलेक्ट्रॉन स्थानांतरित कर सकता है। इसलिए इसकी संयोजकता 4 है।
(2) ऑक्सीजन (\(({ }_{8} \mathrm{Si}^{16})\)) में इलेक्ट्रॉनों का वितरण निम्न होगा
K = 2
L = 6
अतः इसे अपना अष्टक पूरा करने के लिए (8 – 6) = 2 इलेक्ट्रॉनों की साझेदारी करनी होगी। इसलिए इसकी संयोजकता 2 है।
![]()
प्रश्न 8.
उदाहरण के साथ व्याख्या कीजिए-परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर:
परमाणु संख्या-परमाणु के नाभिक में उपस्थित कुल प्रोटॉनों की संख्या उसकी परमाणु संख्या (Z) कहलाती है; जैसे ऑक्सीजन की परमाणु संख्या 8 व कार्बन की परमाणु संख्या 6 है।
द्रव्यमान संख्या – परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या के योग को द्रव्यमान संख्या (A) कहते हैं। जैसे ऑक्सीजन की द्रव्यमान संख्या 16u तथा कार्बन की द्रव्यमान संख्या 12u है।
समस्थानिक – एक ही तत्त्व के ऐसे परमाणु जिनकी परमाणु संख्या समान हो, परंतु द्रव्यमान संख्या भिन्न हो तत्त्व के समस्थानिक कहलाते हैं। जैसे हाइड्रोजन के तीन समस्थानिक प्रोटियम \(({ }_{1} \mathrm{H}^{1})\), ड्यूटीरियम \(({ }_{1} \mathrm{H}^{2})\) व ट्राइटियम \(({ }_{1} \mathrm{H}^{3})\) तथा कार्बन के दो समस्थानिक \(({ }_{6} \mathrm{C}^{12})\) व \(({ }_{6} \mathrm{C}^{14})\) हैं।
समभारिक – समभारिक वे परमाणु होते हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है; जैसे कैल्शियम \(({ }_{20} \mathrm{Ca}^{40})\) तथा आर्गन \(({ }_{18} \mathrm{Ar}^{40})\) समभारिक हैं।
समस्थानिकों के उपयोग
(1) यूरेनियम के एक समस्थानिक (U-235) का उपयोग परमाणु भट्टी (reactor) में ईंधन के रूप में होता है।
(2) कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग होता है।
(3) पेंघा रोग के इलाज में आयोडीन के समस्थानिक का उपयोग होता है।
प्रश्न 9.
Na+ के पूरी तरह से भरे हुए Ka L कोश होते हैं व्याख्या कीजिए। उत्तर-सोडियम परमाणु की परमाणु संख्या 11 होती है। इसलिए सोडियम परमाणु में इलेक्ट्रॉनों की संख्या = 11 अतः सोडियम परमाणु का इलेक्ट्रॉनिक वितरण होगा
K = 2
L = 8
M = 1
यह सोडियम परमाणु स्थाई संरचना प्राप्त करने के लिए एक इलेक्ट्रॉन त्याग कर Na (सोडियम आयन) बन जाएगा जिस कारण इसका इलेक्ट्रॉनिक वितरण K = 2 तथा L = 8 होगा अर्थात K और L कोश पूर्ण भरे होंगे।
प्रश्न 10.
अगर ब्रोमीन परमाणु दो समस्थानिकों \({ }_{35}^{79} \mathrm{Br}\)(49.7%) तथा \({ }_{35}^{81} \mathrm{Br}\) (50.3%)] के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
उत्तर:
ब्रोमीन परमाणु दो समस्थानिकों \({ }_{35} \mathrm{Br}^{79}\) और \({ }_{35} \mathrm{Br}^{81}\) के रूपों में पाया जाता है जिनका द्रव्यमान क्रमशः 49.7% व 50.3% है।
इसलिए ब्रोमीन का औसत परमाणु द्रव्यमान होगा
\(\left(79 \times \frac{49.7}{100}+81 \times \frac{50.3}{100}\right)\)
\(\left(\frac{79 \times 497}{1000}+\frac{81 \times 503}{1000}\right)\)
\(\left(\frac{39263}{1000}+\frac{40743}{1000}\right)\) = 39.263 + 40.743 = 80.006 = 80u
![]()
प्रश्न 11.
एक तत्त्व X का परमाणु द्रव्यमान 16.2u है तो इसके किसी एक नमूने में समस्थानिक \({ }_{8}^{16} \mathrm{X}\) और \({ }_{8}^{18} \mathrm{X}\) का प्रतिशत क्या होगा?
हल
माना समस्थानिक \({ }_{8} \mathrm{X}^{16}\) का प्रतिशत = x
तो \({ }_{8} \mathrm{X}^{18}\) का प्रतिशत = 100 – x
तत्त्व X का औसत परमाणु द्रव्यमान = 16.2u
\(\frac{16 \times x}{100}+\frac{18 \times(100-x)}{100}\) = 16.2
दोनों ओर 100 से गुणा करने पर
16x + 1800 – 18x = 1620
या -2x = 1620 – 1800
या -2x = -180
या x = \(\frac{-180}{-2}\) = 90
अतः नमूने (सैंपल) में \({ }_8 \mathrm{X}^{16}\) का प्रतिशत = 90%
तथा \({ }_8 \mathrm{X}^{18}\) का प्रतिशत = 100 — 90 = 10%
प्रश्न 12.
यदि तत्त्व का Z= 3 हो तो तत्त्व की संयोजकता क्या होगी? तत्त्व का नाम भी लिखिए।
हल
तत्त्व की परमाणु संख्या (Z) = 3
तत्त्व में इलेक्ट्रॉनों की संख्या = 3
इलेक्ट्रॉन वितरण
K = 2
L = 1
अतः तत्त्व के बाह्यतम कोश में 1 इलेक्ट्रॉन है। यह स्थाई विन्यास प्राप्त करने के लिए एक इलेक्ट्रॉन का त्याग कर सकता है। इसलिए तत्त्व की संयोजकता 1 है। अतः तत्त्व लीथियम (Li) है।
प्रश्न 13.
दो परमाणु स्पीशीज़ के केंद्रकों का संघटन नीचे दिया गया है
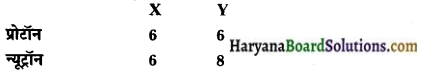
X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज़ में क्या संबंध है?
हल–परमाणु x के लिए
प्रोटॉनों की संख्या = 6
न्यूट्रॉनों की संख्या = 6
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 6+6
= 12
परमाणु Y के लिए
प्रोटॉनों की संख्या = 6
न्यूट्रॉनों की संख्या = 8
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 6+ 8
= 14
ये दोनों स्पीशीज \({ }_6 X^{12}\) और \({ }_6 Y^{14}\) समस्थानिक हैं।
![]()
प्रश्न 14.
निम्नलिखित वक्तव्यों में गलत के लिए F और सही के लिए T लिखें।
(a) जे.जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग \(\frac{1}{2000}\) गुना होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर:
(a) F,
(b) F
(c) T,
(d) F
नोट-प्रश्न संख्या 15, 16 और 17 में सही के सामने (√ ) का चिह्न और गलत के सामने (X) का चिह्न लगाइए।
प्रश्न 15.
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था?
(a) परमाणु केंद्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन
उत्तर:
(a) परमाणु केंद्रक (√),
(b) इलेक्ट्रॉन (x),
(c) प्रोटॉन (x),
(d) न्यूट्रॉन (x)
प्रश्न 16.
एक तत्त्व के समस्थानिक में होते हैं
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या
उत्तर:
(a) समान भौतिक गुण (x),
(b) भिन्न रासायनिक गुण (x),
(c) न्यूट्रॉनों की अलग-अलग संख्या (√),
(d) भिन्न परमाणु संख्या (x)।
![]()
प्रश्न 17.
Cl– आयन में संयोजक इलेक्ट्रॉनों की संख्या है
(a) 16
(b) 8
(c) 17
(d) 18
उत्तर:
(a) 16 (x)।
(b) 8 (√)।
(c) 17 (x)।
(d) 18 (x)।
प्रश्न 18.
सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन-सा है?
(a) 2, 8
(b) 8, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
उत्तर:
सोडियम का सही इलेक्ट्रॉनिक विन्यास
(d) 2, 8, 1 है।
![]()
प्रश्न 19.
निम्नलिखित सारणी को पूरा कीजिए
| परमाणु
संख्या |
द्रव्यमान
संख्या |
न्यूट्रॉनों की
संख्या |
प्रोटॉनों की
संख्या |
इलेक्ट्रॉनों
की संख्या |
परमाणु
स्पीशीज़ |
| 9 | – | 10 | – | – | – |
| 16 | 32 | – | – | – | सल्फर |
| – | 24 | – | 12 | – | – |
| – | 2 | – | 1 | – | – |
| – | 1 | 0 | 1 | 1 | – |
उत्तर
| परमाणु
संख्या |
द्रव्यमान
संख्या |
न्यूट्रॉनों की
संख्या |
प्रोटॉनों की
संख्या |
इलेक्ट्रॉनों
की संख्या |
परमाणु
स्पीशीज़ |
| 9 | 19 | 10 | 9 | 9 | फ्लोरीन |
| 16 | 32 | 16 | 16 | 16 | सल्फर |
| 12 | 24 | 12 | 12 | 12 | मैग्नीशियम |
| 1 | 2 | 1 | 1 | 1 | डूयूटीरियम |
| 1 | 1 | 0 | 1 | 1 | हाइड्रोजन (प्रोटियम) |