Haryana State Board HBSE 10th Class Science Important Questions Chapter 3 धातु एवं अधातु Important Questions and Answers.
Haryana Board 10th Class Science Important Questions Chapter 3 धातु एवं अधातु
अतिलघु उत्तरीय प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
धातुओं के कुछ भौतिक गुण लिखिए। (RBSE 2017)
उत्तर-
धातुएँ भारी, चमकदार, तन्य तथा आघातवर्ध्य होती हैं। ये ऊष्मा और विद्युत की सुचालक होती हैं।
प्रश्न 2.
आघातवर्ध्यता से क्या तात्पर्य है? –
उत्तर-
किसी पदार्थ को हथौड़े से पीटने पर पतली चादर में परिवर्तित हो जाने के गुण को आघातवर्ध्यता कहते हैं।
प्रश्न 3.
कौन-सी धातु सामान्य ताप पर तरल होती है? (RBSE 2016)
उत्तर-
पारा (Hg)।
प्रश्न 4.
एक्वा-रेजिया क्या है?
उत्तर-
एक्वा रेजिया सान्द्र हाइड्रोक्लोरिक अम्ल एवं सान्द्र नाइट्रिक अम्ल को 3 : 1 के अनुपात में मिलाकर बना ताजा मिश्रण है जो सोने व प्लैटिनम को गला सकता है।
प्रश्न 5.
तरल अधातु का नाम बताइए।
उत्तर-
ब्रोमीन।
प्रश्न 6.
निम्नलिखित में सबसे कम क्रियाशील धातुओं को छाँटिए-K, Zn, Ag,Au
उत्तर-
Au.
प्रश्न 7.
आयनिक यौगिकों के कठोर होने का क्या कारण है?
उत्तर-
धनात्मक एवं ऋणात्मक आयनों के बीच मजबूत आकर्षण बल के कारण आयनिक यौगिक ठोस एवं थोड़े कठोर होते हैं।
![]()
प्रश्न 8.
किसी शुद्ध धातु की अपेक्षा उसके मिश्रातु की विद्युत चालकता एवं गलनांक कैसा होता है?
उत्तर-
विद्युत चालकता एवं गलनांक कम होता है।
प्रश्न 9.
किन्हीं दो धातुओं के नाम लिखिए जो हाइड्रोजन से संयुक्त होकर हाइड्राइड बना सकती हैं।
उत्तर-
सोडियम (Na) तथा कैल्सियम (Ca)।
प्रश्न 10.
दो ऑक्साइडों के नाम लिखिए जो न तो अम्लीय हैं और न ही क्षारीय।
उत्तर-
कार्बन मोनोऑक्साइड (CO) तथा नाइट्रस ऑक्साइड (N2O)।
प्रश्न 11.
किस अधातु का गलनांक तथा क्वथनांक उच्च होता है तथा वह अत्यन्त कठोर भी होती है ?
उत्तर-
हीरा (कार्बन)।
प्रश्न 12.
नाइट्रोजन व क्लोरीन परमाणुओं का इलैक्ट्रोनिक विन्यास लिखिए। (RBSE 2016)
उत्तर-
नाइट्रोजन — परमाणु क्रमांक 7 (2, 5)
क्लोरीन – परमाणु क्रमांक 17 (2, 8, 7)
प्रश्न 13.
नाइट्रोजन व क्लोरीन परमाणुओं के मध्य इलैक्ट्रॉनों के स्थानान्तरण से सोडियम क्लोराइड का बनना दर्शाइए। (RBSE 2017)
उत्तर-
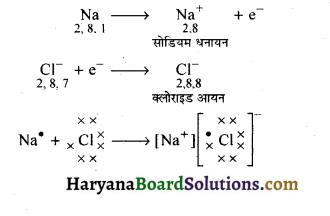
प्रश्न 14.
मिश्रातु क्या होती है?
उत्तर-
किसी धातु का अन्य धातु या अधातु से बना समांगी मिश्रण मिश्रातु कहलाता है।
प्रश्न 15.
अधातुएँ विद्युत का चालन क्यों नहीं करती हैं?
उत्तर-
अधातुओं के पास मुक्त इलेक्ट्रॉन नहीं होते, इस कारण से ये विद्युत का चालन नहीं करती हैं। ये इलेक्ट्रॉनों को ग्रहण करती हैं तथा ऋणायन बनाती हैं।
![]()
प्रश्न 16.
गोल्ड तथा सिल्वर प्रकृति में स्वतन्त्र अवस्था में क्यों पाए जाते हैं?
उत्तर-
गोल्ड तथा सिल्वर बहुत ही कम अभिक्रियाशील हैं, इसलिए ये स्वतंत्र अवस्था में पाए जाते हैं।
प्रश्न 17.
अभी तक कितने तत्व ज्ञात हैं? किन दो वर्गों में इन सभी तत्वों को बाँटा जा सकता है?
उत्तर-
अभी तक कुल 114 तत्व ज्ञात हैं। इन तत्वों को इनके गुणों के आधार पर धातुओं और अधातुओं में बाँटा जा सकता है।
प्रश्न 18.
वायु में रहने पर ऐलुमिनियम की सतह पर कौन-सी परत बन जाती है? इस परत का क्या उपयोग है?
उत्तर-
वायु में रहने पर ऐलुमिनियम की सतह पर ऐलुमिनियम ऑक्साइड की परत बन जाती है। यह परत धातु को संक्षारित होने से बचाती है।
प्रश्न 19.
धातु तथा अधातु किस प्रकार अभिक्रिया करते हैं?
उत्तर-
धातु तथा अधातु एक धातु से दूसरी अधातु पर इलेक्ट्रॉनों के स्थानान्तरण द्वारा अभिक्रिया करते हैं। .धातुओं का निष्कर्षण (Extraction of Metals)
प्रश्न 20.
अयस्क के संवर्धन से क्या तात्पर्य है?
उत्तर-
खनिजों से अवांछित अशुद्धियों को दूर करना अयस्कों का संवर्धन कहलाता है।
प्रश्न 21.
उन धातुओं के नाम बताइए जो अपचायक की भाँति प्रयोग पाई जाती हैं।
उत्तर-
उच्च याशील धातुएँ, जैसे-सोडियम, कैल्सियम अपचायक की भाँति प्रयोग में लाई जाती हैं।
प्रश्न 22.
धातु ऑक्साइड का ऐलुमिनियम चूर्ण द्वारा अपचयित होना कौन-सा प्रक्रम कहलाता है?
उत्तर-
ऐलुमिनियम चूर्ण द्वारा धातु ऑक्साइड का अपचयन ऐलुमिनो थर्मिट प्रक्रम अथवा थर्मिट प्रक्रम कहलाता है।
प्रश्न 23.
पृथ्वी की सतह पर सबसे अधिक पायी जाने वाली धातु का नाम बताइए। इस धातु के महत्त्वपूर्ण अयस्क का नाम लिखिए।
उत्तर-
ऐलुमिनियम। इसका महत्त्वपूर्ण अयस्क बॉक्साइट है।
प्रश्न 24.
अशुद्ध धातुओं के शोधन में सर्वाधिक प्रयुक्त होने वाली विधि कौन-सी है?
उत्तर-
विद्युत-अपघटनी शोधन।
प्रश्न 25.
विद्युत-अपघटनी शोधन द्वारा शुद्ध की जाने वाली प्रमुख धातुएँ कौन-सी हैं?
उत्तर-
कॉपर, जिंक, टिन, निकिल, सिल्वर तथा सोना।
प्रश्न 26.
कॉपर के एक अयस्क का नाम लिखिए।
उत्तर-
क्यूप्रस सल्फाइड (Cu2S)।
प्रश्न 27.
विद्युत-अपघटनी परिष्करण द्वारा परिष्कृत की जाने वाले तीन धातुओं के नाम लिखिए।
उत्तर-
ताँबा (Cu), चाँदी (Ag), टिन (Sn).
प्रश्न 28.
उन धातु ऑक्साइडों के नाम बताइए जो कार्बन के साथ गर्म किए जाने पर धात्विक अवस्था में अपचयित नहीं होते हैं।
उत्तर-
Cr2O3, Mn3O4 अपचायक Al है।
![]()
प्रश्न 29.
गालक से आप क्या समझते हैं?
उत्तर-
गालक वे पदार्थ हैं जो अयस्क में उपस्थित अम्लीय अशुद्धियों को गलनीय पदार्थों में परिवर्तित कर देते हैं।
प्रश्न 30.
निस्तापन से क्या तात्पर्य है?
उत्तर-
निस्तापन वह प्रक्रम है जिसमें कार्बोनेट अयस्क को वायु की अनुपस्थिति में गर्म किया जाता है।
प्रश्न 31.
सोने के आभूषणों में ताँबा क्यों मिलाया जाता है?
उत्तर-
शुद्ध सोना मुलायम होता है जिससे आभूषण नहीं बनाये जा सकते, इस कारण सोने को कठोरता प्रदान करने के लिए सोने में थोड़ा ताँबा मिलाया जाता है।
प्रश्न 32.
पीतल के अवयव घटक लिखिए।
उत्तर-
ताँबा तथा जस्ता।
प्रश्न 33. नाइट्रोजन के ऑक्साइड के नाम लिखिए।
उत्तर-
नाइट्रोजन के तीन ऑक्साइड N2O, NO एवं NO2, हैं।
प्रश्न 34.
पीतल किन धातुओं से मिलकर बनती है?
उत्तर-
पीतल कॉपर व जिंक धातु से मिलकर बनती है।
प्रश्न 35.
किस प्रकार के अयस्कों का भर्जन करते है?
उत्तर-
सल्फाइड अयस्कों का भर्जन करते हैं जिससे ये ऑक्साइड में परिवर्तित हो जाते हैं।
प्रश्न 36.
धातुकर्म के विभिन्न पदों को लिखें।
उत्तर-
धातुकर्म के विभिन्न पद निम्न हैं –
- अयस्क का पीसना (Pulverisation)
- सान्द्रण (Concentration)
- अपचयन (Reduction)
- शोधन (Purification)।
प्रश्न 37.
किसी एक अम्लीय व क्षारीय गालक का उदाहरण दें।
उत्तर-
अम्लीय गालक – SiO2
क्षारीय गालक – CaO.
लघु उत्तरीय प्रश्न (Short Answer Type Questions)
प्रश्न 1.
तत्वों को धातुओं अथवा अधातुओं में वर्गीकृत करते समय विचारणीय गुण बताइए।
उत्तर-
तत्वों को धातुओं एवं अधातुओं में वर्गीकृत करते समय निम्नलिखित गुण आवश्यक रूप से विचारणीय होते-
- चमक,
- चालकता,
- कठोरता,
- वायु में जलना,
- तन्यता,
- ध्वनि,
- अम्लों व जल के साथ अभिक्रिया।
प्रश्न 2.
उपधातुएँ क्या हैं? किन्हीं पाँच उपधातुओं के नाम लिखिए।
उत्तर-
कुछ पदार्थ धातु और अधातु दोनों के गुण प्रदर्शित करते हैं, ऐसे पदार्थों को उपधातु कहते हैं। निम्नलिखित पाँच धातुएँ उपधातुएँ हैं आर्सेनिक (As), पोलोनियम (Po), सिलिकॉन (Si), एंटीमनी (Sb), टेलुरियम (Te)।
प्रश्न 3.
जल में विलेय धातु ऑक्साइडों के उदाहरण दीजिए। जल में घोलने पर धातु ऑक्साइड क्या बनाते हैं?
उत्तर-
सोडियम ऑक्साइड तथा पोटैशियम ऑक्साइड जल में विलेय धातु ऑक्साइड हैं।
Na2O(s)+H2O(l) → 2NaOH
K2O (s) + H2O (l) → 2KOH
धातु ऑक्साइड जल में विलेय होकर क्षार बनाते हैं।
प्रश्न 4.
टाइटेनियम धातु की विशेषता क्या है जिसके कारण इसे सामरिक महत्त्व की धातु कहा जाता है?
उत्तर-
टाइटेनियम धातु अल्प अभिक्रियाशील धातु है इसकी तनाव सहने की क्षमता अत्यधिक होती है, यही कारण है कि इसका प्रयोग नाभिकीय संयन्त्रों, सैन्य उपकरणों, गैस टरबाइनों व जेट इंजनों आदि में होता है। यह धातु शीघ्रता से क्षरित नहीं होती है।
प्रश्न 5.
निम्न अभिक्रियाओं का समीकरण लिखिए
(i) भाप के साथ आयरन की क्रिया
(ii) जल के साथ कैल्सियम तथा पोटैशियम।
उत्तर-
(i) आयरन धातु भाप के साथ क्रिया करके आयरन ऑक्साइड व हाइड्रोजन बनाती है।
3Fe (s) +4H2O (g) → Fe3O4(s) +4H2 (g)
(ii) जल के साथ कैल्सियम व पोटैशियम की क्रिया होने पर सम्बन्धित हाइड्रॉक्साइड बनते हैं तथा हाइड्रोजन गैस निकलती है।

![]()
प्रश्न 6.
सक्रियता श्रेणी किसे कहते हैं? इसकी एक उपयोगिता लिखें।
उत्तर-
सक्रियता श्रेणी (Activity series) धातुओं की क्रियाशीलता को अवरोही क्रम में व्यवस्थित करने पर जो सूची (श्रेणी) प्राप्त होती है, उसे सक्रियता श्रेणी कहते हैं। सक्रियता श्रेणी निम्नवत् है-
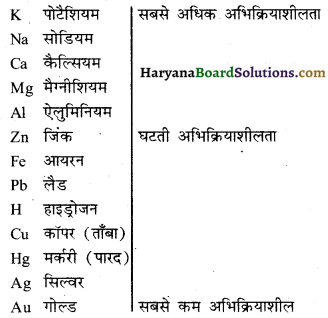
उपयोगिता-इसकी सहायता से हमें तत्वों की क्रियाशीलता की जानकारी होती है।
प्रश्न 7.
विभिन्न धातुओं की जल के साथ अभिक्रियाओं का वर्णन करो। ..
उत्तर-
विभिन्न धातुओं की जल साथ अभिक्रियाएँ निम्नवत् हैं
(i) सोडियम धातु जल के साथ ताव अभिक्रिया करके सोडियम हाइड्रॉक्साइड तथा हाइड्रोजन बनाती है।
2Na (s) +2H2O(l) → 2NaOH (aq)+H2 (g)
(ii) मैग्नीशियम धातु ठण्डे जल की बजाय गर्म जल से अभिक्रिया करके मैग्नीशियम हाइड्रॉक्साइड तथा हाइड्रोजन बनाती है।
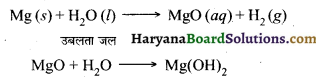
ऐलुमिनियम ठण्डे व गर्म जल से अभिक्रिया नहीं करता है परन्तु यह भाप के साथ अभिक्रिया करके ऐलुमिनियम ऑक्साइड तथा हाइड्रोजन बनाता है।
2Al (s) +3H2O (g) → Al2O3 (s) +3H2 (g)
रक्त तप्त आयरन भाप से अभिक्रिया करके आयरन (II, III) ऑक्साइड तथा हाइड्रोजन बनाता है।
3Fe (s) +4H2O (g) → Fe3O4(s) +4H2 (g)
धातुएँ, जैसे-लैड, कॉपर, गोल्ड, चाँदी, जल के साथ अभिक्रिया नहीं करते हैं।
प्रश्न 8.
(a) निम्नलिखित अभिक्रियाओं के रासायनिक समीकरण लिखिए
(i) कैल्सियम धातु जल से अभिक्रिया करती है।
(ii) सिनाबार को वायु की उपस्थिति में गर्म किया जाता है।
(iii) मैंगनीज डाइऑक्साइड को ऐलुमिनियम पाउडर के साथ गर्म किया जाता है।
(b) मिश्रधातु क्या हैं? मिश्रधातुओं के दो गुणधर्मों की सूची बनाइए। (CBSE 2019)
उत्तर-

(b) दो या दो से अधिक धातुओं अथवा एक धातु व एक अधातु के समांगी मिश्रण को मिश्रधातु कहते हैं।
मिश्रधातु के दो गुणधर्म-
(i) मिश्रधातु धातुओं की तुलना में अधिक शक्तिशाली होती है।
(ii) मिश्रधातु वायु में रखने पर संक्षारित नहीं होती है।
प्रश्न 9.
अधातु क्या हैं ? इनका दैनिक जीवन में क्या महत्त्व है?
उत्तर-
वे तत्व जो धातुओं की तरह व्यवहार नहीं करते हैं, अधातु कहलाते हैं। कमरे के ताप पर अधातुएँ या तो ठोस होती हैं या गैस। इनमें केवल ब्रोमीन ही द्रव रूप में होती है। हाइड्रोजन, नाइट्रोजन, सल्फर, क्लोरीन आदि अधातुओं के उदाहरण हैं।
दैनिक जीवन में अधातुओं का महत्त्व-
- वायु में ऑक्सीजन की उपस्थिति से ही हम सभी साँस लेते हैं तथा यह गैस ज्वलन में सहायक होती है।
- हाइड्रोजन का उपयोग वनस्पति घी एवं अमोनिया के निर्माण में किया जाता है।
- नाइट्रोजन का उपयोग अमोनिया, उर्वरकों तथा नाइट्रिक अम्ल के उत्पादन में किया जाता है।
- सल्फर का उपयोग बारूद बनाने में तथा कवकनाशी दवाइयाँ बनाने में किया जाता है।
प्रश्न 10.
मिश्रधातु किसे कहते हैं? इसके बनाने के उद्देश्यों का वर्णन कीजिए। अथवा मिश्रधातु किसे कहते हैं? दो उदाहरण दीजिए। (RBSE 2017)
उत्तर-
मिश्रधातु या मिश्रातु-किसी धातु का अन्य धातु या अधातु के साथ मिलकर बनाया गया समांगी मिश्रण, मिश्रातु कहलाता है। उदाहरण के लिए; पीतल, कांसा, सोल्डर, स्टील आदि सभी मिश्रातु हैं।
मिश्रातुओं के उपयोग-
- मिश्रातु बनाने से कठोरता बढ़ जाती है, जैसे-लोहे में कार्बन की मात्रा मिलाकर स्टेनलेस स्टील बनाया जाता है जो लोहे से अधिक कठोर होता है। सोने में ताँबा मिलाने से उसकी कठोरता बढ़ जाती है।
- संक्षारण रोकने के लिए मिश्रातु उपयोगी है, जैसे-लोहे तथा जिंक से बनी मिश्रातु पर जंग नहीं लगता।
- घरों में मिश्रातुओं का उपयोग बहुत अधिक होता है। घरों के बर्तन, पंखे, अलमारी आदि में मिश्रातुओं का प्रयोग होता है।
प्रश्न 11.
निम्नलिखित की व्याख्या कीजिए
(a) सोडियम क्लोराइड एक आयनी यौगिक है जो ठोस अवस्था में विद्युत का चालन नहीं करता है जबकि यह पिघली अवस्था के साथ-साथ जलीय विलयन में विद्युत का चालन करता है।
(b) नाइट्रिक अम्ल में डुबोने पर ऐलुमिनियम की सक्रियता कम हो जाती है।
(c) कैल्सियम और मैग्नीशियम जैसी धातुएँ प्रकृति में मुक्त अवस्था में नहीं पायी जाती हैं। (CBSE 2019)
उत्तर-
(a) सोडियम क्लोराइड ठोस अवस्था में विद्युत का चालन नहीं करता परन्तु पिघली अवस्था के साथ-साथ जलीय विलयन में विद्युत का चालन करता है क्योंकि सोडियम क्लोराइड के आयन उसकी कठोर संरचना के कारण गतिशील नहीं होते। विद्युत चालन के लिए आयनों का गतिशील होना आवश्यक है। पिघली और जलीय अवस्था में आयन गति के लिए मुक्त होते हैं अतः वे विद्युत संचालित करते हैं।
(b) नाइट्रिक अम्ल एक शक्तिशाली ऑक्सीकारक है इसलिए ऐलुमिनियम को इसमें डुबाने पर, ऐलुमिनियम ऑक्साइड की परत जम जाती है, जिसके कारण इसकी सक्रियता कम हो जाती है।
(c) कैल्सियम और मैग्नीशियम धातुएँ प्रकृति में मुक्तावस्था में नहीं पाई जाती हैं क्योंकि अधिक क्रियाशील होने के कारण ये अन्य तत्वों के साथ अभिक्रिया करके यौगिकों का निर्माण करती हैं।
![]()
प्रश्न 12.
सक्रियता श्रेणी में सबसे ऊपर स्थित धातुओं के निष्कर्षण की विधि, सक्रियता श्रेणी के मध्य में स्थित धातुओं के निष्कर्षण की विधि से किस प्रकार भिन्न है? उनके लिए भी समान प्रक्रिया क्यों नहीं अपनायी जाती है? इन धातुओं के निष्कर्षण की प्रक्रिया का नाम लिखिए। (CBSE 2019)
उत्तर –
| सक्रियता श्रेणी में सबसे ऊपर स्थित धातुओं का निष्कर्षण (K, Na, Ca, Mg तथा AI) | सक्रियता श्रेणी में मध्य में स्थित धातुओं का निष्कर्षण (Zn, Fe, Pb) |
| 1. इस प्रकार की धातुएँ बहुत अधिक क्रिया- शील होती हैं। | 1. इस प्रकार की वस्तुएँ मध्यम क्रियाशील होती हैं। |
| 2. इन धातुओं को वैद्युत अपघटन विधि द्वारा प्राप्त किया जाता है। | 2. इन धातुओं के यौगिकों(कार्बोनेट तथा सल्फा- इड) के पहले ऑक्साइड में बदला जाता है फिर उनका अपघटन करके धातु को प्राप्त किया जाता है। इस प्रक्रिया को निस्तापन या भर्जन कहा जाता है। |
इन धातुओं के लिए समान प्रक्रिया नहीं अपनाई जा सकती क्योंकि सक्रियता श्रेणी में सबसे ऊपर स्थित धातुओं के ऑक्साइडों को कार्बन के साथ अपघटित नहीं किया जा सकता। कार्बन के साथ अपघटित होने की अवस्था में ये धातुएँ कार्बन से क्रिया करके कार्बाइड यौगिक बना देंगी जिससे हम धातु प्राप्त नहीं कर पाएंगे।
प्रश्न 13.
वात्या भट्टी में हेमेटाइट अयस्क से आयरन के निष्कर्षण में होने वाली रासायनिक अभिक्रियाओं का वर्णन कीजिए।
उत्तर-
लोहे के अयस्क, कोक, चूने के पत्थर को भट्टी में एक साथ रखकर उच्च ताप दिया जाता है। इस उच्च ताप के कारण चूने का पत्थर निम्न रासायनिक अभिक्रिया के रूप में विघटित हो जाता है-
CaCO3 → CaO+CO2,
कैल्सियम ऑक्साइड, सिलिकन डाइऑक्साइड के साथ अभिक्रिया करता है तथा कैल्सियम सिलिकेट द्रवित रूप में बनाता है।
CaO + SiO2 → CaSiO3
इस प्रकार प्राप्त सिलिकन ऑक्साइड से मुक्त लोहे के ऑक्साइड का अपचयन हो जाता है।
प्रश्न 14.
धातु शोधन की गलनिक पृथक्करण विधि क्या है?
उत्तर-
धातु शोधन की इस विधि में एक ढलावदार भट्टी का प्रयोग किया जाता है, अशुद्ध धातु को भट्टी के ऊपरी भाग में एक जाली के ऊपर रखा जाता है। भट्टी के ताप को इस प्रकार बढ़ाया जाता है कि वह गलनांक के ऊपर स्थिर रहे। ताप के कारण धातु पिघलकर नीचे आ जाती है तथा अशुद्धियाँ जाली पर शेष रह जाती हैं। टिन, लेड बिस्मथ आदि धातुएँ इसी प्रकार शोधित की जाती हैं।
प्रश्न 15.
खनिज तथा अयस्क में अन्तर स्पष्ट कीजिए।
उत्तर-
| खनिज | अयस्क |
| 1. उन प्राकृतिक पदार्थों को जिनमें धातुओं के यौगिक पाए जाते हैं, खनिज कहलाते हैं। | 1. जिन खनिजों से धातुएँ सुविधापूर्वक प्राप्त की जा सकती हैं, उन्हें अयस्क कहते हैं। |
| 2. कुछ खनिजों में आपत्तिजनक अशुद्धियाँ होती हैं जो धातु के निष्कर्षण को बाधित करती हैं। | 2. इनमें किसी भी प्रकार की आपत्तिजनक अशुद्धि नहीं होती है। |
| 3. सभी खनिजों को धातु निष्कर्षण के लिए प्रयुक्त नहीं किया जा सकता। | 3. सभी अयस्कों को धातु निष्कर्षण के लिए प्रयुक्त किया जा सकता है। |
प्रश्न 16.
कुछ आयनिक यौगिकों के नामों को उनके सूत्र तथा उनमें उपस्थित आयनों के साथ लिखिए। .
उत्तर-
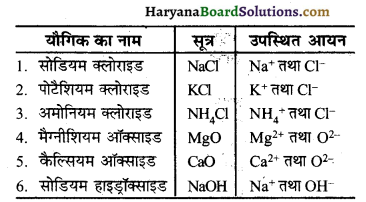
प्रश्न 17.
Ca, Pb,AI,Na,Mg एवं Cuमें से किन-किन धातुओं को विद्युत अपघटनी विधि द्वारा निष्कर्षित किया जाता है और क्यों?
उत्तर-
ऐसी धातुएँ जो अत्यधिक क्रियाशील एवं अत्यधिक धनविद्युती प्रकृति की होती हैं वह अच्छी अपचायक होती हैं। अतः ऐसी धातुओं का निष्कर्षण रासायनिक अपचयन द्वारा नहीं किया जा सकता है। इनका निष्कर्षण केवल विद्युत अपघटनी विधि से ही करते हैं। इस कारण Ca, AI, Na तथा Mg का निष्कर्षण विद्युत अपघटनी विधि से करते हैं।
प्रश्न 18.
प्रमुख मिश्रातुओं के नाम, उनके घटक तथा उपयोग लिखिए।
उत्तर-
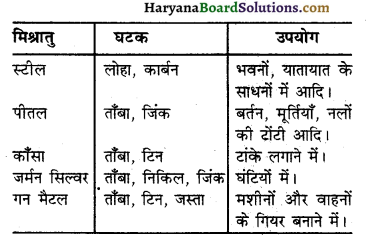
प्रश्न 19.
जंग लगाना किसे कहते हैं? लोहे पर जंग लगने की परिस्थितियों की जाँच के लिए किसी क्रियाकलाप का नामांकित आरेख सहित वर्णन कीजिए। (CBSE 2020)
उत्तर-
किसी लोहे की वस्तु को काफी समय तक नम वायु में रखने पर, इसके ऊपर भूरे रंग की आयरन ऑक्साइड की परत बनने के प्रक्रम को जंग लगना कहते हैं। (पाठ्य पुस्तक में क्रियाकलाप 3.14 देखिए)।
प्रश्न 20.
जंग लगने से बचाने के कुछ उपायों को बताइए।
उत्तर-
जंग लगने से बचाने के लिए निम्नलिखित उपाय किए जाते हैं-
- तेल या ग्रीस की तह आदि लोहे पर जमा पीतल दी जाए तो नम वायु लोहे के सम्पर्क में नहीं आ पाती जिससे जंग नहीं लगती है।
- लोहे की सतह पर रंग-रोगन करके जंग लगने से बचाया जा सकता है। बसों, कारों, स्कूटर आदि पर एनमल की तह जमाई जाती है।
- लोहे पर जस्ते की परत जमा कर (यशदलेपन) इसे जंग लगने से बचाया जाता है, जैसे-लोहे की बाल्टियाँ, चादरों आदि पर यह प्रक्रिया अपनायी जाती है।
- निकिल, क्रोमियम आदि धातुओं की तह विद्युत् लेपन के द्वारा लोहे की सतह पर चढ़ाने से जंग नहीं लगती है, जैसे-वाहनों के रिम, हैंडिल आदि।
प्रश्न 21.
निस्तापन और भर्जन में अंतर बताइए।
उत्तर-
हवा की सीमित सप्लाई में अयस्क को गलन के ताप तक गर्म करके उसमें से नमी एवं वाष्पशील पदार्थों को अलग करने की क्रिया को निस्तापन कहते हैं जबकि हवा की मुक्त सप्लाई में अयस्क को गलन से कम ताप पर गर्म करके ऑक्सीकृत करना भर्जन कहलाता है।
दीर्घ उत्तरीय प्रश्न (Long Answer Type Questions)
प्रश्न 1.
धातुओं के महत्त्वपूर्ण गुणधर्म लिखिए।
उत्तर-
धातुओं के महत्त्वपूर्ण गुणधर्म निम्नलिखित हैं-
- धातुएँ ऊष्मा व विद्युत की सुचालक होती हैं तथा लैड व पारा ऊष्मा के कुचालक होते हैं।
- धातुओं में चमक होती है, इन पर पॉलिश की जा सकती है।
- इनमें आघातवर्धनीयता होती है अर्थात् इन्हें पीटकर चादरों में बदला जा सकता है।
- इनमें तन्यता होती है अर्थात् इन्हें खींचकर इनके तार बनाए जा सकते हैं।
- इनमें कठोरता होती है परन्तु सोडियम (Na) व पोटैशियम (K) धातुएँ होकर भी नरम हैं।
- धातुएँ सामान्य ताप पर ठोस अवस्था में रहती हैं। केवल पारा द्रव अवस्था में रहता है।
- धातुओं का घनत्व उच्च होता है परन्तु सोडियम (Na) व पोटैशियम (K) धातुएँ हल्की हैं।
- धातुएँ प्रबल होती हैं तथा इनके गलनांक व क्वथनांक उच्च होते हैं। परन्तु सोडियम (Na) व पोटैशियम (K) के गलनांक व क्वथनांक निम्न होते हैं।
- धातुएँ कठोर सतह से टकराकर ध्वनि उत्पन्न करती हैं।
![]()
प्रश्न 2.
धातुओं एवं अधातुओं के बीच कैसे विभेद करेंगे? (CBSE 2017)
उत्तर-
धातुओं एवं अधातुओं के गुणों में विभेद भौतिक गुणों में विभेद –

रासायनिक गुणों में विभेद
| धातुएँ | अधातुएँ |
| 1. धातुओं द्वारा क्षारीय ऑक्साइड का निर्माण होता है जिसमें से कुछ क्षार बनाती हैं। | 1. अधातुएँ अम्लीय एवं उदासीन ऑक्साइड बनाती हैं। |
| 2. धातुएँ धनात्मक आवेश की प्रकृति की होती हैं। | 2. अधातुएँ ऋणात्मक आवेश की प्रकृति की होती हैं। |
| 3. धातुएँ अपचायक हैं। | 3. अधातुएँ ऑक्सीकारक हैं। |
| 4. धातुएँ जलीय विलयन में धनायन बनाती हैं। | 4. अधातुएँ जलीय विलयन में ऋणायन बनाती हैं। |
प्रश्न 3.
धातु एवं अधातु किस प्रकार अभिक्रिया करते हैं? समझाइए।
उत्तर-
धातु एवं अधातु अपने संयोजक कक्ष में पाए जाने वाले इलेक्ट्रॉनिक विन्यास के आधार पर अभिक्रिया करते हैं, उदाहरण के लिए-सोडियम का परमाणु क्रमांक 11 है अतः इसका इलेक्ट्रॉनिक विन्यास 2, 8 1 है। इसके सबसे बाहरी कक्ष में केवल 1 इलेक्ट्रॉन है। यदि यह अपना एक इलेक्ट्रॉन सबसे बाहरी कक्ष से त्याग देता है तब यह Na’ (सोडियम धनायन) प्रदान करता है। दूसरी ओर क्लोरीन का परमाणु क्रमांक 17 है जिसका इलेक्ट्रॉनिक विन्यास 2, 8 7 है। इस प्रकार क्लोरीन के सबसे बाहरी कोश में 7 इलेक्ट्रॉन हैं अतः यह 1 इलेक्ट्रॉन ग्रहण करके अपना अष्टक पूर्ण कर सकता है। इससे क्लोराइड ऋणायन Cl– प्राप्त होता है।

प्रश्न 4.
अधातु क्या हैं? इनके रासायनिक गुणधर्मों को बताइए।
उत्तर-
जो तत्व धातुओं की तरह व्यवहार नहीं करते हैं, अधातु कहलाते हैं। हाइड्रोजन, नाइट्रोजन, कार्बन, सल्फर, क्लोरीन आदि अधातुओं के उदाहरण हैं अधातुओं के रासायनिक गुणधर्म-अधातुएँ इलेक्ट्रॉनों को ग्रहण करके, ऋण आवेशित आयन (ऋणायन) बनाती हैं। अतः इनको ऋण विद्युत तत्व कहते हैं।
Cl+e– → Cl–
0+2e– → O2-
(i) ऑक्सीजन से अभिक्रिया-अधातुएँ ऑक्सीजन से क्रिया करके ऑक्साइड बनाती हैं।
C(s) + O2(g) → CO2(g)
अधातुओं के ऑक्साइड अम्लीय या उदासीन होते हैं। कार्बन डाइऑक्साइड अम्लीय ऑक्साइड है जोकि जल में घुलकर अम्ल बनाती है तथा इसका जलीय विलयन नीले लिटमस पत्र को लाल कर देता है।
CO2(g)+ H2O(l) → H2CO3(aq) (कार्बोनिक अम्ल)
(ii) अम्लों से क्रिया-अधातुएँ तनु अम्लों से हाइड्रोजन विस्थापित नहीं करती हैं। तनु अम्लों से अधातुओं द्वारा हाइड्रोजन का विस्थापन तभी सम्भव है जबकि अभिक्रिया द्वारा उत्पन्न प्रोटॉनों (H+) को इलेक्ट्रॉनों की पूर्ति की जाए।
H2SO4(aq) → 2H+ (aq) + SO42-(aq)
2H+ (aq) + 2e– →H2(g)
धातुएँ इलेक्ट्रान को ग्रहण करने वाली होती हैं।
(iii) क्लोरीन से अभिक्रिया-अधातुएँ क्लोरीन से अभिक्रिया करके क्लोराइड बनाती हैं। ये सह संयोजी यौगिक के रूप में होती हैं जो सामान्यतया वाष्पशील द्रव या गैस होती हैं।
P4(s) + 6Cl2(g) → 4PCl3(g) (फॉस्फोरस ट्राइक्लोराइड)
(iv) हाइड्रोजन से अभिक्रिया-अधातुएँ हाइड्रोजन से क्रिया करके हाइड्राइड बनाती हैं।

प्रश्न 5.
सन्तुलित रासायनिक समीकरण लिखकर व्याख्या कीजिए कि क्या होता है जब-
(i) मरक्यूरिक ऑक्साइड को गरम किया जाता है।
(ii) क्यूप्रस ऑक्साइड और क्यूप्रस सल्फाइड के मिश्रण को गरम किया जाता है।
(iii) ऐलुमिनियम की मैंगनीज डाइऑक्साइड से अभिक्रिया करायी जाती है।
(iv) फेरिक ऑक्साइड को ऐलुमिनियम के साथ अपचयित किया जाता है।
(v) जिंक कार्बोनेट का निस्तापन होता है। (CBSE 2020)
उत्तर-
(i) जब मरक्यूरिक ऑक्साइड को 300 °C पर गरम किया जाता है तो यह विघटित हो जाती है तथा पारा धातु (Hg) प्राप्त होती है।
![]()
(ii) क्यूप्रस ऑक्साइड और क्यूप्रस सल्फाइड के मिश्रण को जब ऑक्सीजन की अनुपस्थिति में गरम किया जाता है तो ताँबा धातु और सल्फर डाइऑक्साइड गैस प्राप्त होते हैं।
![]()
(iii) जब ऐलुमिनियम की मैंगनीज डाइऑक्साइड से अभिक्रिया करायी जाती है तो MnO, का अपचयन होता है तथा Mn धातु प्राप्त होती है। A1 धातु एक अपचायक का कार्य करता है।
3MnO2(s) + 4AI(s) →3Mn(1) + 2Al2O3 (s)
(iv) फेरिक ऑक्साइड को जब ऐलुमिनियम के साथ अपचयित किया जाता है तो Fe2O3, का अपचयन होता है तथा पिघला हुआ तरल Fe (लोहा) धातु प्राप्त होती है।
Fe2O3 (s) + 2Al(s) → 2Fe(l) + Al2O3 (s)
(v) जिंक कार्बोनेट की विस्थापन अभिक्रिया से कार्बोनेट अयस्क, जिंक ऑक्साइड में परिवर्तित हो जाता है।
![]()
प्रश्न 6.
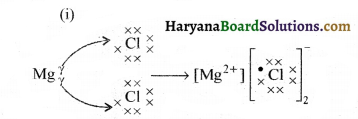
(i) इलेक्ट्रॉनों के स्थानान्तरण द्वारा मैग्नीशियम क्लोराइड में आबन्ध बनना दर्शाइए तथा इस यौगिक में उपस्थित आयनों की पहचान कीजिए।
(ii) आयनी यौगिक ठोस होते हैं। इसका कारण दीजिए।
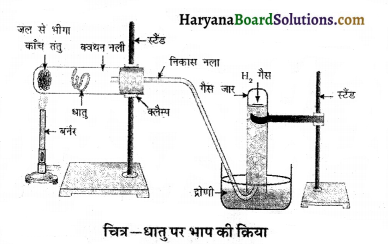
(iii) किसी धातु पर भाप की क्रिया को दर्शाने के लिए प्रायोगिक व्यवस्था का नामांकित आरेख खींचिए। (CBSE 2020)
उत्तर-
(ii) आयनी यौगिकों के विपरीत आवेशित आयन परस्पर – अधिक मात्रा के वैद्युत बल के कारण काफी पास पाए जाते हैं, इसलिए आयनिक यौगिक ठोस होते हैं।
(iii)
प्रश्न 7.
कारण बताइए-
(a) प्लेटिनम, सोना तथा चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम पोटैशियम को केरोसिन तेल के अन्दर . संग्रहित किया जाता है।
उत्तर-
(a) प्लेटिनम, सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है, क्योंकि ये धातुएँ सक्रियता श्रेणी में निम्नतम स्थान पर होती हैं तथा जल, ऑक्सीजन अथवा अम्लों से अभिक्रिया नहीं करतीं। ये संक्षारित भी नहीं होती। ये धातएँ आघातवर्ध्यनीय तथा तन्य होती हैं; इसलिए आभूषणों के विभिन्न डिजाइन सरलतापूर्वक बनाए जा सकते हैं।
(b) सोडियम एवं पोटैशियम धातु का ज्वलन ताप (Ignition Temperature) अत्यन्त ही कम होता है, वायु के सम्पर्क में आते ही यह आग पकड़ लेता है। सोडियम, पोटैशियम का वायु से सम्पर्क रोकने के लिए सोडियम एवं पोटैशियम को केरोसिन में डुबोकर रखा जाता है।
![]()
प्रश्न 8.
अयस्क किसे कहते हैं? ताँबे के परिष्करण की विद्युत अपघटनी विधि का सचित्र वर्णन करें। (CBSE 2018)
उत्तर-
अयस्क (Ores)-जिन खनिजों में किसी विशेष धातुं की मात्रा अधिक रूप से होती है, जिसे निकालना लाभकारी होता है, उन्हें अयस्क कहते हैं।
तांबे के परिष्करण की विद्युत् अपघटनी विधि-इस विधि में अशुद्ध धातु को ऐनोड बनाते हैं तथा उसी धातु की शुद्ध धातु की पट्टी को कैथोड की तरह प्रयुक्त करते हैं। इन दोनों इलेक्ट्रोडों को एक उपयुक्त वैद्युत अपघटनी विश्लेषित्र में रखते हैं जिसमें उसी धातु का लवण घुला रहता है। अधिक क्षारकीय धातुएँ विलयन में रहती हैं तथा कम क्षारकीय धातुएँ ऐनोड पंक में चली जाती हैं।
उदाहरण-ताँबे का शोधन इस विधि से करते हैं। अशुद्ध कॉपर ऐनोड के रूप में तथा शुद्ध कॉपर पत्ती कैथोड के रूप में लेते हैं। कॉपर सल्फेट का अम्लीय विलयन वैद्युत अपघटनी होता है तथा वैद्युत अपघटन के परिणामस्वरूप शुद्ध कॉपर ऐनोड से कैथोड की तरफ स्थानान्तरित हो जाता है।
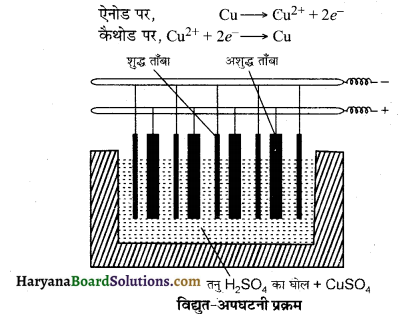
फफोलेदार कॉपर से अशुद्धियाँ ऐनोड पंक के रूप में जमा होती हैं। इनमें ऐण्टिमनी, सिलीनियम, टेल्यूरियम, चाँदी, सोना तथा प्लैटिनम मुख्य धातुएँ होती हैं। इस विधि से प्राप्त धातु में 99.98% शुद्धता होती है।
प्रश्न 9.
(a) थर्मिट प्रक्रिया किसे कहते हैं? इस प्रक्रिया का उपयोग कहाँ किया जाता है? इसमें होने वाली रासायनिक अभिक्रिया का सन्तुलित रासायनिक समीकरण लिखिए।
(b) इस प्रक्रिया में उपयोग होने वाली धातु ऐलुमिनियम का, धातु की सक्रियता श्रेणी में स्थान कहाँ पर है?
(c) इस प्रक्रिया में उपचयित तथा अपचयित होने वाले पदार्थों के नाम लिखिए।
उत्तर-
(a) जब ऐलुमिनियम धातु को आयरन ऑक्साइड के साथ गर्म करके अभिक्रिया करवाई जाती है तो इसे थर्मिट प्रक्रिया कहते हैं। इस प्रक्रिया में गर्म तरल लोहा धातु प्राप्त होती है। इस प्रक्रिया का उपयोग रेलवे लाइनों की वैल्डिंग करके मरम्मत करने में किया जाता है।

(b) ऐलुमिनियम धातु, धातुओं की सक्रियता श्रेणी में अधिक क्रियाशील श्रेणी में आती है।
(c) इस प्रक्रिया में आयरन ऑक्साइड का अपचयन होता है तथा आयरन (लोहा) धातु प्राप्त होती है। ऐलुमिनियम धातु का उपचयन होता है और उससे Al2O3 प्राप्त होता है।
प्रश्न 10.
कार्बन, सोडियम, मैग्नीशियम तथा ऐलुमिनियम के ऑक्साइडों से इनकी निजी धातुओं को अपचयित नहीं कर सकती हैं, क्यों? धातुओं की सक्रियता श्रेणी में इन धातुओं को कहाँ रखा गया है? इन धातुओं को इनके अयस्कों से किस प्रकार प्राप्त किया जा सकता है? कोई एक उदाहरण लेकर रासायनिक समीकरणों सहित धातु को निष्कर्षित करने की प्रक्रिया की व्याख्या कीजिए। (CBSE 2020)
उत्तर-
सोडियम, मैग्नीशियम तथा ऐलुमिनियम धातुएँ, कार्बन से अधिक क्रियाशील हैं, इसलिए इनके ऑक्साइड कार्बन से अपचयित नहीं हो पाते जिसके कारण ये धातुएँ प्राप्त नहीं हो पाती हैं। इन धातुओं को सक्रियता श्रेणी में सबसे ऊपर रखा गया है क्योंकि ये अधिक क्रियाशील धातुएँ हैं। इन धातुओं को इनके अयस्कों से वैद्युत अपचयन विधि द्वारा प्राप्त किया जाता है।
ऐलुमिनियम धातु का उसके ऑक्साइड अयस्क से निष्कर्षण करना-एक विशेष प्रकार के विद्युत सैल में तरल ऐलुमिनियम ऑक्साइड में से जब विद्युत धारा प्रवाहित की जाती है तो इसके अपचयन से हमें ऐलुमिनियम धातु तरल रूप में ऋण टर्मिनल (कैथोड) पर प्राप्त होती है।

प्रश्न 11.
कोई धातु X जिसका उपयोग थर्मिट प्रक्रिया में होता है, ऑक्सीजन में गर्म किए जाने पर कोई ऑक्साइड Y बनाती है जो प्रकृति में उभयधर्मी है। X और Y को पहचानिए। ऑक्साइड Y की हाइड्रोक्लोरिक अम्ल और सोडियम हाइड्रॉक्साइड के साथ अभिक्रियाओं के सन्तुलित रासायनिक समीकरण लिखिए। (CBSE 2019)
उत्तर-
जब ऐलुमिनियम को ऑक्सीजन में गर्म किया जाता है तो ऐलुमिनियम ऑक्साइड बनता है जो प्रकृति में उभयधर्मी है।
4Al2 + 3O2 → 2Al2O3
‘X’ ऐलुमिनियम धातु है।
‘Y’ ऐलुमिनियम ऑक्साइड (Al2O3) है।
ऐलुमिनियम ऑक्साइड की हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया
Al2O3 + 6HCl → 2Alcl3 + 3H2O ऐलुमिनियम ऑक्साइड की सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया-
Al2O3 + 2NaOH → 2NaAlO2 + H2O
प्रश्न 12.
(a) आयनिक यौगिकों के कोई दो भौतिक गुण कारण सहित लिखिए।
(b) दो ऐसी धातुओं के नाम लिखिए जो पृथ्वी की ऊपरी परत में स्वतंत्र रूप में पाई जाती हैं। वह धातुओं की क्रियामाला में किस स्थान पर स्थित हैं? (c) जो धातु, धातुओं की क्रियामाला में सबसे ऊपर पायी जाती है उन्हें उनके ऑक्साइडों से कार्बन के साथ क्रिया अपचयित करके प्राप्त क्यों नहीं किया जा सकता?
उत्तर-
(a) आयनिक यौगिकों के कोई दो भौतिक गुण-
(i) इनका गलनांक व क्वथनांक उच्च होता हैं क्योंकि उनके विपरीत आवेशित आयन परस्पर अधिक वैद्युत आकर्षण बल के कारण जुड़े रहते हैं।
(ii) अपने जल के विलयन के रूप में यह विद्युत धारा के सुचालक होते हैं क्योंकि विलयनों के रूप में इनके आयन स्वतन्त्र होकर विद्युत धारा को प्रवाहित कर पाते हैं।
(b) सोना तथा प्लेटिनम धातु पृथ्वी की ऊपरी परत में स्वतंत्र रूप में पाई जाती हैं। ये धातुएँ, धातुओं की क्रियामाला में नीचे की ओर स्थित होती हैं।
(c) इन धातुओं के ऑक्साइड कार्बन के साथ क्रिया करके अपने कार्बाइड यौगिक बनाते हैं, इसलिए इनके ऑक्साइडों का अपचयन कार्बन द्वारा नहीं किया जा सकता।
प्रश्न 13.
एक धातु M प्रकृति में अपने कार्बोनेट अयस्क के रूप में पाया जाता है। इसका उपयोग लोहे के जस्तीकरण के लिए भी किया जाता है। इस धातु M को पहचानिए तथा इसके इस अयस्क का नाम लिखिए। इस अयस्क से इस धातु को कैसे प्राप्त किया जा सकता है? (CBSE 2018)
उत्तर-
धातु M जस्ता (जिंक) है। इसका संकेत Zn है। इसका कार्बोनेट अयस्क (ZnCO3) है जिसे कैलेमाइन अयस्क कहते हैं।
इस अयस्क से Zn धातु प्राप्त करना-
(i) पहले जिंक कार्बोनेट अयस्क को निस्तापन क्रिया द्वारा जिंक ऑक्साइड यौगिक में बदला जाता है। जब जिंक कार्बोनेट को उच्च ताप पर वायु की अनुपस्थिति में गर्म किया जाता है तो यह विघटित होकर जिंक ऑक्साइड तथा कार्बन डाइऑक्साइड बनाता है।

(ii) अब जिंक ऑक्साइड को कार्बन (कोक) के साथ गर्म करने पर ऑक्साइड का अपचयन हो जाता है, तथा जिंक धातु प्राप्त हो जाती है।

बहुविकल्पीय प्रश्न (Objective Type Questions)
1. इनमें से सबसे अधिक अभिक्रियाशील धातु कौन-सी है-
(a) सीसा
(b) पारा
(c) सोडियम
(d) लोहा।
उत्तर-
(c) सोडियम।
2. निम्न धातुओं में से कौन-सी धातु प्रकृति में मुक्त अवस्था में पायी जाती है –
(a) सोडियम
(b) गोल्ड
(c) पोटैशियम
(d) ऐलुमिनियम।
उत्तर-
(b) गोल्ड।
3. जब धातुएँ किसी कठोर सतह से टकराती हैं तो एक आवाज उत्पन्न होती है। इन धातुओं को कहते हैं –
(a) ध्वनिक
(b) सोनोरस
(c) उपर्युक्त दोनों
(d) इनमें से कोई नहीं।
उत्तर-
(c) उपर्युक्त दोनों।
![]()
4. कौन-सी धातु ठण्डे या गर्म जल से क्रिया नहीं करती
(a) Na
(b) Ca
(c) Mg
(d) Fe.
उत्तर-
(d) Fe.
5. निम्न में से कौन-सी धातुएँ मुक्त अवस्था में प्रकृति में पायी जाती हैं –
(i) Cu
(ii) Au
(iii) Zn
(iv) Ag
(a) (i), (ii)
(b)(i), (iii)
(c) (ii), (iv)
(d) (iii), (iv).
उत्तर-
(c) (ii), (iv).
6. सोने और प्लैटिनम को गलाने वाले अम्ल का नाम है
(a) सान्द्र HCL
(b) एक्वा-रेजिया
(c) सान्द्र नाइट्रिक अम्ल
(d) इनमें से कोई नहीं।
उत्तर-
(b) एक्वा-रेजिया।
7. पृथ्वी की भूपर्पटी में सर्वाधिक मात्रा में मिलने वाली धातु है –
(a) आयरन
(b) कॉपर
(c) ऐलुमिनियम
(d) मर्करी।
उत्तर-
(c) ऐलुमिनियम।
8. कौन-सी अधातु चमकयुक्त होती है ?
(a) सल्फर
(b) ऑक्सीजन
(c) नाइट्रोजन
(d) आयोडीन।
उत्तर-
(d) आयोडीन।
9. कौन-सी अधातु द्रव अवस्था में होती है –
(a) कार्बन
(b) ब्रोमीन
(c) फॉस्फोरस
(d) सल्फर। .
उत्तर-
(b) ब्रोमीन।
10. ऐलुमिनियम पर मोटी ऑक्साइड की परत बनने की प्रक्रिया को कहते हैं –
(a) ऐनोडीकरण
(b) कैथोडीकरण
(c) तन्यता
(d) कठोरता।
उत्तर-
(a) ऐनोडीकरण।
11. Fe2O3 + 2Al → 2Fe + Al2O3 + ऊष्मा, इस अभिक्रिया का क्या नाम है-
(a) ऐनोडीकरण
(b) थर्मिट
(c) यशदलेपन
(d) इनमें से कोई नहीं।
उत्तर-
(b) थर्मिट।
![]()
12.कॉपर को खुला छोड़ देने पर उस पर हरे रंग की परत जम जाती है। इसका कारण है –
(a) CuSO4
(b) CuCO3
(c) Cu(NO3)2
(d)CuO.
उत्तर-
(a) CuSO4
13. यशदलेपन में किस धातु की परत चढ़ाई जाती है –
(a) ताँबा
(b) ऐलुमिनियम
(c) जस्ता.
(d) चाँदी।
उत्तर-
(c) जस्ता।
14. सल्फाइड अयस्क को वायु की उपस्थिति में गर्म करने को कहते हैं –
(a) निस्तापन
(b) संयोजन
(c) भर्जन
(d) दहन।
उत्तर-
(c) भर्जन।
15. कार्बोनेट अयस्क को वायु की अनुपस्थिति में गर्म करने को कहते हैं –
(a) निस्तापन
(b) संयोजन
(c) भर्जन
(d) दहन।
उत्तर-
(a) निस्तापन।
16. अमलगम एक मिश्रातु है जो एक या एक से अधिक धातुओं का –
(a) मर्करी के साथ मिश्रण होता है |
(b) सोडियम के साथ मिश्रण होता है |
(c) कैल्सियम के साथ मिश्रण होता है |
(d) पोटैशियम के साथ मिश्रण होता है।
उत्तर-
(a) मर्करी के साथ मिश्रण होता है।
17. निम्न में से उदासीन ऑक्साइड है
(a) कार्बन डाइऑक्साइड
(b) कार्बन मोनोऑक्साइड
(c) सल्फर डाइऑक्साइड
(d) सल्फर ट्राइऑक्साइड।
उत्तर-
(b) कार्बन मोनोऑक्साइड।
18. जंग लगने के लिए
(a) केवल वायु की आवश्यकता होती है
(b) केवल जल की आवश्यकता होती है
(c) वायु एवं जल दोनों की आवश्यकता होती है
(d) वायु एवं जल दोनों की आवश्यकता नहीं होती है।
उत्तर-
(c) वायु एवं जल दोनों की आवश्यकता होती है।
![]()
19. अयस्क से गैंग को दूर करने को कहते हैं –
(a) निस्तापन
(b) भर्जन
(c) समृद्धीकरण
(d) अपचयन।
उत्तर-
(c) समृद्धीकरण।
20. सीसा एवं टिन की मिश्रातु को कहते हैं
(a) अमलगम
(b) सोल्डर
(c) काँसा
(d) इनमें से कोई नहीं।
उत्तर-
(b) सोल्डर।
रिक्त स्थानों की पूर्ति कीजिए (Fill In the blanks)
1. ऑक्सीजन के साथ संयुक्त होकर धातुएँ ……………………………… बनाती हैं।
उत्तर-
क्षारकीय ऑक्साइड,
2. भू-पर्पटी में प्राकृतिक रूप से पाये जाने वाले तत्वों या यौगिकों को …………………………….. कहते हैं।
उत्तर-
खनिज,
3. रेल की पटरी और मशीन के पुों की दरारों को …………………………….. द्वारा जोड़ा जाता है।
उत्तर-
थर्मिट अभिक्रिया,
4. सोडियम, मैग्नीशियम तथा ऐलुमिनियम धातुएँ, …………………………….. से अधिक क्रियाशील हैं।
उत्तर-
कार्बन,
5. अधातुएँ ऊष्मा की …………………………….. होती हैं, केवल ग्रेफाइट अधातु ऊष्मा की …………………………….. है।
उत्तर-
कुचालक, सुचालक।
सुमेलन संबंधी प्रश्न (Matrix Type Questions)
प्रश्न 1.
निम्न को सुमेलित कीजिये।
| कॉलम (1) (धातु) | कॉलम (ii) (धातु के अयस्क) |
| 1. ऐलुमिनियम | (a) कैलेमाइन (Calamine) |
| 2. आयरन | (b) डोलोमाइट (Dolomite) |
| 3. लेड | (c) सिनेबार (Cinnabar) |
| 4. मरकरी | (d) हीमेटाइट (Haematite) |
| 5. जिंक | (e) गैलेना (Galena) |
| 6. कैल्सियम | (f) बॉक्साइट (Bauxite) |
उत्तर-
| कॉलम (1) (धातु) | कॉलम (ii) (धातु के अयस्क) |
| 1. ऐलुमिनियम | (f) बॉक्साइट (Bauxite) |
| 2. आयरन | (d) हीमेटाइट (Haematite) |
| 3. लेड | (e) गैलेना (Galena) |
| 4. मरकरी | (c) सिनेबार (Cinnabar) |
| 5. जिंक | (a) कैलेमाइन (Calamine) |
| 6. कैल्सियम | (b) डोलोमाइट (Dolomite) |
![]()
प्रश्न 2.
निम्न को समेलित करें –
| कॉलम-I | कॉलम-II |
| 1. विद्युत अपघटनी अपचयन | (a) एल्युमीनियम |
| 2. कार्बन से अपचयन | (b) जिंक |
| 3. एल्युमीनियम से अपचयन | (c) सोडियम |
| (d) आयरन | |
| (e) मैग्नीशियम | |
| (f) क्रोमियम |
उत्तर-
1. विद्युत अपघटनी अपचयन → (a) एल्युमीनियम, (c) सोडियम
2. कार्बन से अपचयन → (b) जिंक, (d) आयरन
3. एल्युमीनियम से अपचयन → (e) मैग्नीशियम, (f) क्रोमियम